

Prof. Dr. Wilfried Brade (Hannover/Dummerstorf), Prof. Dr. K. Wimmers (Dummerstorf)
Die Landwirtschaft in Deutschland trägt maßgeblich zur Emission klimaschädlicher Gase bei. Dafür verantwortlich sind vor allem Methan-Emissionen aus der Tierhaltung sowie Lachgas-Emissionen aus landwirtschaftlich genutzten Böden als Folge beispielsweise der Stickstoffdüngung.
Das klimawirksame Spurengas Methan (CH4) entsteht vor allem während des Verdauungsprozesses (enterische Fermentation) von Wiederkäuern (aber auch Monogastriden) sowie bei der Lagerung von Wirtschaftsdüngern (Festmist, Gülle) und wird spätestens bei deren Ausbringung freigesetzt.
Die CH4-Emissionen sind vor allem auf die Rinderhaltung – bedingt bereits durch deren quantitativen Umfang – zurückzuführen; darunter sind Milchkühe die bedeutendsten Emittenten (12).
Darüber hinaus wird CH4 bei der Abwasser- und Klärschlammbehandlung sowie die Klärschlammverwertung in der Landwirtschaft gebildet und freigesetzt.
Der Pansen ist eine prägastrische Fermentationskammer mit einem sehr komplexen mikrobiellen Ökosystem. Er entstand in einer bereits viele Millionen Jahre umfassenden Koevolution der Wiederkäuer mit zahlreichen Mikroorganismen (2).
Die hier vorhandene Symbiose zwischen dem Wiederkäuer (Wirt) und seinem Mikrobiom ist für beide Partner von Vorteil. So übernehmen die ruminalen Mikroorganismen Aufgaben, die im Genom eines Wiederkäuers nicht verankert sind (Abbildung 1). Dazu gehört unter anderem der Abbau von Nahrungsbestandteilen (zum Beispiel Cellulose), die sie allein nicht zu verdauen vermögen.
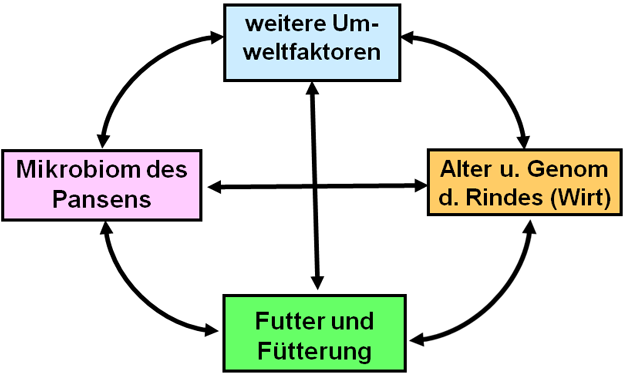
Abbildung 1: Wechselwirkungen zwischen verschiedenen Faktoren bei der Verdauung von Pflanzen oder Pflanzenteilen im Pansen eines Rindes.
Das im Pansen vorhandene ruminale Ökosystem besteht aus Mitgliedern aller drei Domänen des Lebens: Bacteria, Archaea und Eukarya.
Allerdings ist bisher erst ein Bruchteil aller Pansenmikroorganismen bekannt, da viele von ihnen durch herkömmliche Methoden, wie zum Beispiel der In-vitro-Kultivierung auf Nährmedien, nicht erfassbar sind (3).
Bakterien sind die quantitativ bedeutendsten Mitglieder der ruminalen mikrobiellen Gemeinschaft (24, 26, 30, 34, 44, 50).
Im Laufe des Lebens oder bei veränderter Fütterung/Haltung des Wirtes kommt es zu strukturellen und funktionellen Veränderungen des ruminalen Mikrobioms.
Zu nennen sind hier deutliche Unterschiede im Mikrobiom eines juvenilen Rindes (präruminales Kalb), einer kraftfutterreich ernährten Milchkuh oder eines raufutterreich ernährten Mastrindes.
Die Zahl der Protozoen, hauptsächlich Ciliaten, beträgt rund 0,5 Millionen pro Milliliter Pansensaft. Sie leben von Bakterien, können aber auch Cellulose oder Stärke vergären (19, 21, 34).
Im Gegensatz zu den Bakterien sind sie für den Wirt nicht lebensnotwendig.
Gut bekannt ist, dass Protozoen "Räuber" von Bakterien und anderen Mikroorganismen sind. Sie greifen somit regulierend in die Bakterienpopulationen ein. Eine Veränderung in der Häufigkeit oder der Zusammensetzung der Protozoen wirkt sich folglich auf die gesamte ruminale Mikrobengemeinschaft aus.
Eine Reduktion der ruminalen Protozoen-Dichte (Defaunation) ist in der Regel mit einer Reduktion der CH4-Emission je Kilogramm Futter-Trockenmasseaufnahme (TA) verbunden (19).
Zusätzlich sind Hefen und andere anaerobe Pilze in geringerer Dichte im Pansen vorhanden. Sie sind gleichfalls am Abbau von (Hemi-)Cellulosen oder weiterer Polymere beteiligt (3, 34).
Der Pansen beinhaltet darüber hinaus ein komplexes Virom, dessen Viren systematisch die Zellen von Eukaryoten oder Prokaryoten befallen. So wird der Pansen von einer großen Anzahl von Bakteriophagen bewohnt, die wahrscheinlich dazu beitragen, dass eine "Homöostase" der mikrobiellen Population erreicht wird. Schätzungen nennen hier bis zu 1011 Phagenpartikel pro Gramm Panseninhalt (2).
Das ruminale Mikrobiom mit seiner Fähigkeit einerseits zur Kolonisation an pflanzlichen Partikeln und andererseits zur Enzymbildung ermöglicht erst den Abbau der Zellwandbestandteile (Abbildung 2).
Die durch die Hydrolyse der Zellwandbestandteile oder der Stärke gebildeten Monomere werden in einer anaeroben Glykolyse (einschließlich weiterer Stoffwechselzyklen [zum Beispile Pentose-Phosphat-Zyklus]) zu Pyruvat umgesetzt. Pyruvat, das zentrale Zwischenprodukt dieses mikrobiellen Kohlenhydratstoffwechsels, wird anschließend über verschiedene Stoffwechselwege zu kurzkettigen Fettsäuren (Acetat, Propionat, Butyrat) weiter umgebaut, bei der auch Pansengase (CO2, CH4) entstehen (Abbildung 2).
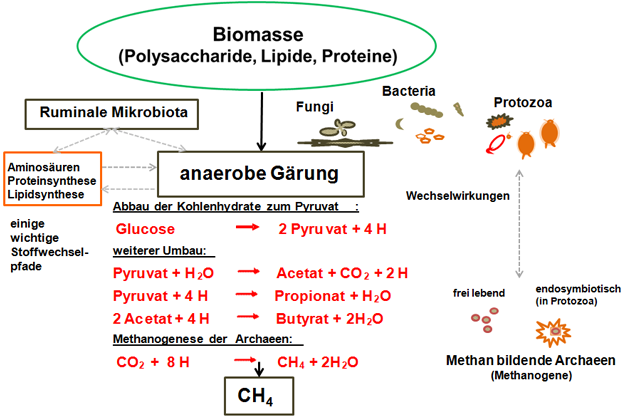
Abbildung 2: Schematische Darstellung der anaeroben Verdauung von Biomasse mit abschließender CH4-Bildung durch methanbildende Archaeen (Methanogene).
Quelle: Eigene Darstellung.
CH4 wird durch methanogene Archaeen produziert. Ihre CH4-Synthese kann als Endprodukt ihrer speziellen Atmung angesehen werden (Abbildung 2).
Diese CH4-Bildung ist aus zweierlei Hinsicht nachteilig: CH4 führt einerseits zu einem Energieverlust zwischen fünf bis zwölf Prozent der aufgenommenen Energie durch den Wirt. Zum anderen wird ein Treibhausgas erzeugt, das der Wirt wiederum in die Umwelt freisetzt (Ruktus).
Die ruminale mikrobielle Gemeinschaft ist bemerkenswert vielfältig.
Molekulare Studien haben einen "mikrobiellen Kern" sowohl bei den bakteriellen Stämmen Firmicutes (hier insbesondere die Gattungen Ruminococcus und Butyrivibrio) und Bacteroidetes (hier insbesondere die Gattung Prevotella) als auch bei vielen anderen Taxa identifiziert (24,25, 51,52).
Gleichzeitig demonstriert die ruminale mikrobielle Gemeinschaft eine bemerkenswerte Redundanz (überlappende Verteilung der physiologischen Funktionen über mehrere mikrobielleTaxa) sowie Resilienz (Fähigkeit zur Wiederherstellung der Struktur nach akuter oder chronischer Störung).
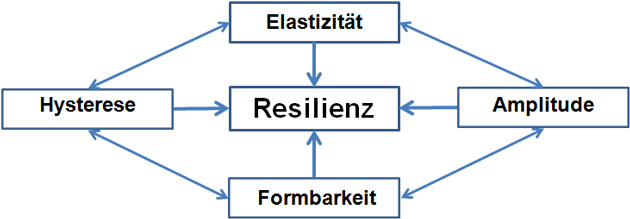
Abbildung 3: Komponenten der Resilienz in einem Ökosystem.
Quelle: Eigene Darstellung.
Anmerkungen: Elastizität: Schnelligkeit der Wiederherstellung des Ausgangszustandes nach Störung; Amplitude: ein Maß dafür, wie weit sich ein Ökosystem vom Ausgangszustand entfernen kann und dennoch zurückzukehren vermag; Formbarkeit: Ausmaß der Unterscheidung nach Wiedererreichung eines stabilen Zustandes; Hysterese: Pfad der Wiederherstellung des Ausgangszustandes nach Störung.
Diese beiden Eigenschaften gewährleisten eine hohe Stabilität vor allem der Verdauungsfunktion für den Wirt (zum Beispiel bei wechselnden Fütterungs- und Haltungsbedingungen).
Die Wirtsspezifität des Mikrobioms wurde durch wiederholte Versuche demonstriert, bei der – nach einem fast vollständigen, paarweisen Austausch von Panseninhalt – Milchkühe in der Lage waren, ihre differenzierte Artenzusammensetzung oder ihren unterschiedlichen Pansen-pH-Wert oder ihr variierendes ruminales VFA-Profil (VFA: Flüchtige Fettsäuren) selbst wieder herzustellen (51,52).
Die Methanogenese wird – wie bereits dargestellt – von methanogenen Archaeen betrieben.
CH4-bildende Archaeen sind sowohl in der Pansenflüssigkeit, angeheftet an ruminalem Partikelmaterial oder in Einheit mit Protozoen (Endosymbionten), zu finden als auch am Pansenepithel des Wirtes "angedockt" (26,43).
Die mikrobielle Artendichte variiert zusätzlich in Abhängigkeit von der Fütterung und damit mit dem H2-Angebot und/oder den untersuchten Wiederkäuer-Spezies (22, 42). Der Standort des Wirts spielt für die mikrobielle Vielfalt gleichfalls eine Rolle (22, 23).
Es gibt viele Ansätze zur Reduzierung von enterischem CH4 (Abbildung 4).
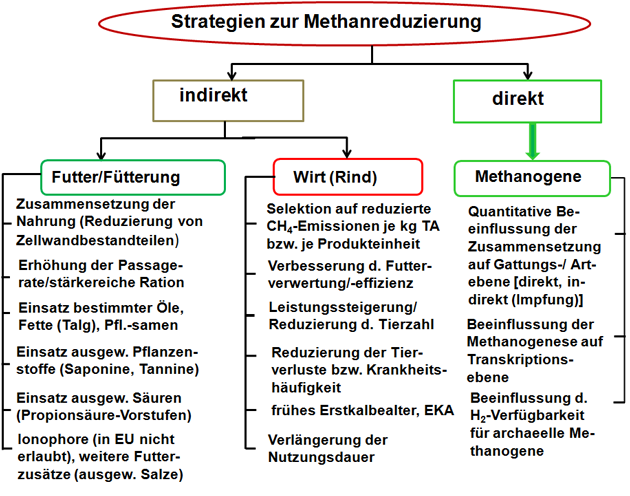
Abbildung 4: Verschiedene Strategien zur Methanreduzierung.
Quelle: Eigene Darstellung.
Anmerkung: TA: Trockenmasseaufnahme.
Mögliche Methan-Minderungsstrategien können in direkt oder indirekt wirkende gegliedert werden.
Beim aktuellen Kenntnisstand der Methanogenese sind vor allem indirekte Methan-Minderungsstrategien – wie die Reduzierung der Tierverluste und Verlängerung der Nutzungsdauer oder die Rationsgestaltung – für die Praxis empfehlenswert (Abbildung 4).
Eine genetisch-züchterische Einflussnahme auf den tierindividuellen CH4-Ausstoß setzt voraus, dass Informationen zum Einzeltier in praxi vorliegen. Von aktuellem Interesse sind In-vivo-Verfahren zur tierindividuellen Messung der CH4-Emissionen von Wiederkäuern.
In jüngster Zeit sind hier einige neuere Entwicklungen im Praxistest, die den bisherigen "Gold-Standard", die Respirationskammer unter Versuchsbedingungen, zunehmend abzulösen versuchen.
Eine Alternative scheint – vor allem für Weidetiere – die Schwefelhexafluorid-Tracer-Technik (SF6-Tracer-Technik) zu sein (1).
Die technischen Fähigkeiten und logistischen Anforderungen der Umsetzung der SF6-Tracer-Technik einschließlich patentrechtlicher Probleme (US-Patent: 5405247 A) begrenzen deren umfassende Nutzung in praxi. Die Methode führte jedoch bereits – trotz ihrer im Vergleich zur Respirationskammerergebnissen geringeren Genauigkeit – zu interessanten Resultaten; speziell unter Weidebedingungen (17, 36).
Neuere Messverfahren, die derzeit als Alternative zur teuren und aufwendigen "Respirationskammer" und zur SF6-Tracer-Technik getestet werden, sind der Methan-Laserdetektor und neuerdings auch die Analyse des (mittleren) Infrarot-Spektrums (IR-Spektrums) von tierindividuellen Milchproben. Sie erlauben zwar nicht die Bestimmung der emittierten Methanmenge, liefern aber die zugehörige Konzentration oder einen Schätzwert für den Methan-Output pro Kilogramm Milch.
Als Referenzmethode dient nach wie vor vorzugsweise die Respirationskammer, in der ausgewählte Einzeltiere hinsichtlich ihrer verschiedenen Gasemissionen parallel bewertet werden.
Der Methandetektor (kurz: LMD) ist ein handliches Lasergerät, dessen Laserstrahl auf die Nasenlöcher des Tieres gerichtet wird, um das über den Ruktus abgegebene Gas zu analysieren (6,7). Erste Ergebnisse an einem begrenzten Datenmaterial mit Milchkühen bestätigen eine tierindividuelle Wiederholbarkeit der LMD-Messergebnisse (40).
Weitere aktuelle Entwicklungen sind spezielle "Futterstationshauben" oder auch sogenannte "Sniffer". Eine "Futterstationshaube" ist fest über einem Futterstationstrog installiert und somit stationär. Diese Hauben sind ventiliert, sodass die vom Tier während der Fütterung abgegebenen Gase abgesaugt und quantitativ bewertet werden können. Demgegenüber arbeiten die "Sniffer" ohne Luftstrommessung.
Ergänzt werden die Messungen der Gasemissionen in Versuchseinrichtungen häufig durch die Analyse von Pansensaftproben, um auf der Basis des relativen Anteils der methanbildenden Archaeen eine zusätzliche Bewertung des ruminalen Mikrobioms zu erhalten.
Für einen selektiven und sensitiven Nachweis von Milchinhaltsstoffen (exakter: Molekülgruppen) kommt dem mittleren Infrarotlichtbereich besondere Bedeutung zu, da die meisten Moleküle charakteristische Absorptionsbanden in dieser Wellenlängenregion aufweisen (46).
Alle Landeskontrollverbände (LKV) setzen bei der Analyse von Milchproben (zum Beispiel Milchfettgehalt) bereits aktuell Geräte ein, deren Messtechnik mit Licht des mittleren Infrarotbereiches arbeitet.
Erste zugehörige Studien von (9) und (47) belegen auch die Möglichkeit, individuelle CH4-Emissionen von Milchkühen auf Basis von mittleren Infrarot-Spektren (MIR-Spektren) in der Milch vorherzusagen (Abbildung 5).
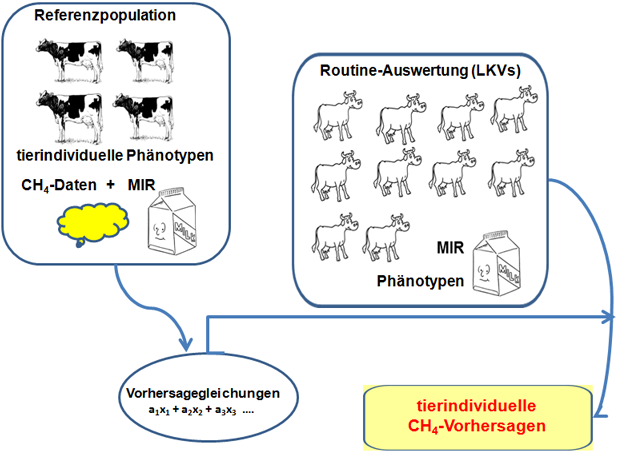
Abbildung 5: Nutzung von MIR-Daten aus der Milchleistungsprüfung (MLP) zur tierindividuellen CH4-Vorhersage in praxi.
Quelle: Eigene Darstellung.
Tierindividuelle CH4-Vorhersagen je Tag oder je Kilogramm Milch auf der Basis von MIR-Spektren in der Milch sind wiederholbar. Zugehörige Heritabilitäten (Erblichkeiten, h2) sind jedoch deutlich geringer als für Produktionsmerkmale (Tabelle 1).
| Tabelle 1: Ergebnisse aus MIR-Analysen von Milchproben | |||
|---|---|---|---|
| Kenngröße/Merkmal | Laktations-Nummer der bewerteten Kühe | ||
| 1. Laktation | 2. Laktation | 3. Laktation | |
| MIR-CH4 (g/kg FPCM) | 23,66 ± 8,21 | 21,51 ± 8,53 | 20,37 ± 8,56 |
| FPCM (kg/Tag) | 23,98 ± 5,64 | 27,58 ± 7,50 | 29,32 ± 8,27 |
| h2 (MIR-CH4 g/Tag) | 0,12 ± 0,005 | 0,10 ± 0,005 | 0,09 ± 0,007 |
Quelle: (27, gekürzt).
Anmerkung: FPCM: auf Fett- und Eiweißgehalt korrigierte Milchmenge.
Gleichzeitig werden negative Beziehungen dieser CH4-Vorhersagen je Kilogramm Milch und tierindividuellen Mengenmerkmalen beschrieben (Tabelle 2).
| Tabelle 2: Phänotypische (rp) und genetische (rg) Korrelationen zwischen den Merkmalen | ||
|---|---|---|
| Merkmalsbeziehung MIR-CH4 (g/kg FPCM) : | Korrelationen | |
| rp | rg | |
| FPCM (kg/T) | - 0,74 | - 0,83 |
| Fett-kg (kg/T) | - 0,68 | - 0,63 |
| Eiweiß-kg (kg/T) | - 0,70 | - 0,78 |
Quelle: (27, gekürzt).
Anmerkungen: T: Trockenmasse; FPCM: auf Fett- und Eiweißgehalt korrigierte Milchmenge.
Dies entspricht wiederum der Erwartung (9, 27, 47).
Zweifellos lassen sich aktuell – über die Höhe der Futteraufnahme und die Rationszusammensetzung – die zu erwartenden CH4-Emissionen (noch) viel genauer vorhersagen als mittels MIR-Daten aus der Milchleistungsprüfung (MLP). Auch bleiben die nicht-laktierenden Tiere bei letzterer außen vor.
Doch genau diese Eingangsdaten fehlen routinemäßig in praxi, sodass die vielen, interessanten Vorhersagegleichungen, die in der Literatur zu finden sind (13, 14), nicht angewendet werden können.
MIR-Spektren der Milch könnten somit (zukünftig) die Etablierung eines kostengünstigen Routineverfahrens zur Bewertung des CH4-Anfalls pro Kilogramm Milch ermöglichen und damit ein Benchmark zur Bewertung von Herden/Betrieben zwecks Betriebsberatung (-kontrolle) – bei fehlenden Details zu Fütterung/Management – werden.
CH4 entsteht als unvermeidliches Nebenprodukt des mikrobiellen Kohlenhydrat-Abbaus unter anaeroben Bedingungen (Abbildung 2).
Von den verschiedenen relevanten Faktoren hat bereits die Höhe der Futteraufnahme einen deutlichen Einfluss auf die tägliche CH4-Emission bei Wiederkäuern (38). Bezogen auf ein Kilogramm Trockenmasseaufnahme (TA) schwanken die Angaben über die Höhe der CH4-Bildung zwischen etwa 18 und 25 Gramm bei laktierenden Milchkühen (13). Extreme Werte werden häufig durch hohe Anteile spezifischer Futtermittel (Nährstoffe) verursacht, wobei niedrige CH4-Werte vor allem bei stärke- und fettreichen Rationen und hohe CH4-Werte vor allem bei faserreichen Rationen gemessen werden.
(48) berichteten kürzlich von einer mittleren CH4-Emission von 21,5 ± 2,46 g/kg TA und 13,9 ± 2,30 g/kg Milch (FCM) bei hochleistenden Milchkühen.
Nicht zu bezweifeln ist, dass bereits die verabreichte Diät einen bedeutenden Einfluss auf die zu beobachtenden CH4-Emissionen besitzt (11, 31, 35).
Es gibt zwischenzeitlich aber auch Belege dafür, dass zwischen den Tieren (Wirten) tierindividuelle Unterschiede – bei Verabreichung einer gleichen Diät – existieren, die wiederholbar und damit züchterisch nutzbar sind. Hier liegen gesicherte (und damit auch quantitativ ausreichende) Ergebnisse vor allem bei Schafen vor, da ihre Prüfung vergleichsweise weniger aufwendig und kostenintensiv als eine Bewertung von hochleistenden Milchkühen ist.
(41) berichten über eine "indirekte" Heritabilität von etwas über zehn Prozent für die Methanemission je Kilogramm Trockenmasseaufnahme bei Schafen (Tabelle 3).
| Tabelle 3: Berechnete Heritabilitäten (h2) und Wiederholbarkeiten (r2) für die Methanemission von Schafen | ||||
|---|---|---|---|---|
| Merkmal/Kenngröße | Mittelwerte (x) | phänotypische Standardabweichung (sp) | h2 | r2 |
| g CH4/kg T | 15,7 | 1,62 | 0,13 ± 0,03 | 0,24 ± 0,02 |
| Lebensmasse (kg) | 48,5 | 5,12 | 0,46 ± 0,07 | 0,80 ± 0,01 |
Quelle: (41, gekürzt).
Anmerkungen: T: Trockenmasse; Tiermaterial 1225 getestete Schafe.
Noch geringer sind die h2-Werte (h2 < 0,07) in ersten Studien bei Milchkühen; allerdings stand hier nur ein sehr begrenztes Datenmaterial zur Verfügung (40).
Interessant sind in diesem Zusammenhang die Arbeiten von (16) bezüglich pansenmorphologischer Unterschiede zwischen Schafen mit differenzierten CH4-Emissionen. Sie wählten – aus einer genügend großen Kohorte (über 700 Schafe) – je zehn Tiere mit hoher oder niedriger CH4-Emission. Mittels Computertomografie (CT) wurde anschließend die zugehörige ruminale Größe und Morphologie bei den Mutterschafen bewertet.
Die niedrigen CH4-Emittenten hatten ein kleineres Pansenvolumen und eine kürzere Retentionszeit (Tabelle 4).
| Tabelle 4: Beobachtete Unterschiede zwischen zwei Mutterschafgruppen (je zehn hohe oder zehn niedrige Methanemittenten bewertet) | |||
|---|---|---|---|
| Kenngröße | hohe Methanemittenten | niedrige Methanemittenten | Signifikanz (P-Werte) |
| T-Aufnahme je Tag | 1026 | 988 | n. s. |
| Methanerzeugung (g CH4/kg T-Aufnahme) | 23,5 | 20,8 | 0,001 |
| Verdaulichkeit der T (in Prozent) | 66,4 | 64,8 | n. s. |
| mittlere Retentionszeit in Tagen (d) – partikelbasierend | 1,34 | 1,11 | 0,002 |
| Pansenvolumen (Liter) | 7,42 | 5,91 | 0,048 |
Quelle: (16, gekürzt).
Anmerkungen: T: Trockenmasse; n. s.: nicht signifikant.
Diese Ergebnisse sind insofern für die Zuchtpraxis wertvoll, da eine intensive und einseitige Selektion von Wiederkäuern auf reduzierte CH4-Emission unerwünschte anatomisch-physiologische Änderungen bei den Wirten zur Folge haben könnte.
(50) berichten über die CH4-Erzeugung von Mastbullen unterschiedlicher Rinderrassen. Die Mastrinder aus zwei verschiedenen Rassengruppen (35 Aberdeen Angus-Bullen sowie 33 Limousin-Kreuzungen) emittierten eine unterschiedliche CH4-Menge je Tag. Wurden jedoch die CH4-Emissionen bezüglich der Trockenmasseaufnahme korrigiert, waren die Unterschiede zwischen den Rassen nicht mehr gegeben; jedoch weiterhin für den gewählten Rationstyp (Tabelle 5).
| Tabelle 5: Methanerzeugung von Mastbullen in Abhängigkeit von der Rasse und der Futterration | ||||||
|---|---|---|---|---|---|---|
| Rationstyp | kraftfutterreiche Diät | Diät mit mittlerem Kraftfutteranteil | Signifikanzprüfung | |||
| Rasse | AA* | Lim* | AA | Lim | Rasse | Futter |
| Gramm Methan pro Tag | 152 | 135 | 216 | 194 | * | *** |
| Gramm Methan je Kilogramm T-Aufnahme | 13,5 | 13,6 | 21,3 | 22,3 | n. s. | *** |
Quelle: (50).
Anmerkungen: AA*: Aberdeen Angus; Lim*: Limousin-Kreuzungen; T: Trockenmasse; *: P < 0,05; ***: P < 0,001; n. s.: nicht signifikant.
Die Restfutteraufnahme (RFA), definiert als Differenz zwischen beobachteter und erwarteter FA, ist ein (neuerer) Ansatz, um die Futtereffizienz – speziell bei wachsenden Tieren (Mastrindern) – zu bewerten (20, 28, 39, 50). Es scheint, dass effiziente Rinder (mit niedriger RFA) im Vergleich zu Rindern mit hoher RFA weniger Methan emittieren (Tabelle 6).
| Tabelle 6: Methanerzeugung von wachsenden Angus-Stieren mit geringer (L-RFA) und hoher Restfutteraufnahme (H-RFA) | |||
|---|---|---|---|
| Kenngröße | L-RFA | H-RFA | Signifikanztest (P-Werte) |
| T-Aufnahme (kg/Tag) | 8,38 | 14,13 | < 0,001 |
| tägliche Zunahme (g/Tag) | 1126 | 1229 | 0,21 |
| Methanemission (g/Tag) | 142,3 | 190,2 | 0,01 |
| Methanemission (g/kg Zunahme) | 131,8 | 173,0 | 0,09 |
| Methanemission (g/kg T-Aufnahme) | 16,3 | 14,7 | 0,37 |
Quelle: (20, gekürzt).
Ähnliche Beobachtungen wurden auch bei Schafen gemacht. (55) konnten zusätzlich belegen, dass unterschiedliche RFA-Gruppen ähnliche Gesamthäufigkeiten an methanogenen Archaeen in ihren Pansen hatten, aber ineffizientere Mastrinder eine vielfältigere methanogene Gemeinschaft; verglichen mit den effizienteren Tieren.
Auch (4) untersuchten die Struktur der ruminalen Methanogene bei wachsenden Rindern mit hoher versus niedriger RFA (je 14 weibliche Tiere aus beiden RFA-Gruppen). Sie belegen gleichfalls eine hohe strukturelle Ähnlichkeit der Methanbildner in beiden Tiergruppen. Jedoch wurden Häufigkeitsunterschiede bei einigen methanogenen Archaeen in Abhängigkeit von der verabreichten Diät (Raufutteranteil: hoch versus gering) aufgezeigt.
Zwischenfazit: Die aktuell vorliegenden Ergebnisse zeigen, dass einerseits ein "ruminaler Kern" von Methanogenen im Pansen existiert und anderseits die Fütterung sowie zum Teil (noch unbekannte) Komponenten des Wirts signifikante Unterschiede in der Häufigkeitsverteilung vorhandener methanogener Genotypen bewirken können.
Wirtbezogene Faktoren, wie die Pansen-Morphologie, das Fressverhalten, die Speichelproduktion oder auch die Thermoregulation (Hitzestress), haben offensichtlich einen weiteren Einfluss auf die Futterverwertung und die Methanbildung.
Eine der bedeutendsten Maßnahmen zur Verminderung von Treibhausgasen war in jüngster Zeit die züchterische Erhöhung von Leistungsmerkmalen (zum Beispiel Milchleistung bei Milchkühen – Abbildung 4).
Höhere Milchleistungen (oder tägliche Zunahmen bei Masttieren) führen zu einer effektiveren Umwandlung der Futternährstoffe in nutzbare Tierprodukte und damit zu einer verminderten Ausscheidung an CH4 je Produktmenge (8, 13, 24). Diese Effekte sind nachvollziehbar, da sich die für den Erhaltungsbedarf notwendigen Nährstoffmengen auf eine größere Produktmenge verteilen. (5) berichten, dass sich die CO2-Bilanz (CO2-Footprint) pro Kilogramm Milch in der Zeit von 1944 bis 2007 in den USA – infolge der enormen Leistungssteigerung bei gleichzeitiger Verdrängung unproduktiver Rassen durch Holstein-Rinder und generell besserem Management/Fütterung und Krankheitsprophylaxe – mehr als halbierte.
Aus globaler Sicht ist aktuell die weitere Leistungserhöhung bei Wiederkäuern eine sehr effektive CH4-Minderungsstrategie (15). Demgegenüber dürfte die indirekte Maßnahme "Leistungssteigerung" in Nordwesteuropa oder in Nordamerika bereits weitestgehend ausgeschöpft sein.
Neben der Leistungshöhe und einer damit möglichen Reduzierung der Anzahl benötigter Milchkühe (Ziegen, Schafe), speziell unter den Bedingungen gesättigter Märkte, gibt es jedoch weitere Möglichkeiten, wie beispielsweise eine kurze Aufzuchtperiode, gesunde und leistungsstarke Tiere oder die Verlängerung der Nutzungsdauer der Milchkühe und Mutterschafe (Abbildung 4).
Da die Minderungspotenziale durch Leistungssteigerung bereits an anderer Stelle intensiv besprochen wurden, sollen sie an dieser Stelle nicht weiter diskutiert werden (14).
Zwischenfazit: In jüngster Vergangenheit konnte durch eine enorme Leistungssteigerung, vor allem der Milchleistung, in Deutschland und anderen Ländern, bereits ein Beitrag zum Klimaschutz seitens der Tierzucht und -haltung geleistet werden. Vor dem Hintergrund des bereits sehr hohen Leistungsniveaus der gehaltenen Milchkühe in Deutschland und in benachbarten Staaten gewinnen nun weitere Managementmaßnahmen, wie die weitere Verbesserung der Nutzungsdauer und Tiergesundheit – auch im Hinblick auf den Ressourcen- und Umweltschutz – an zusätzlicher Bedeutung.
Die Tierernährung verfügt aktuell über verschiedene (begrenzte) Möglichkeiten zur indirekten Verminderung der CH4-Bildung.
Anzumerken ist, dass im Pansen der Wiederkäuer – als wichtigster mikrobieller Verdauungsraum – die größte CH4-Bildung erfolgt. Dagegen sind die im Dickdarm der Wiederkäuer anfallenden CH4-Mengen relativ gering und nahezu zu vernachlässigen.
Ein indirektes CH4-Reduzierungspotential stellt bereits die Menge und Zusammensetzung der verabreichten Nahrung dar (Abnahme des Anteils schwer verdaulicher Zellwandbestandteile; Zunahme des Kraftfutteranteils in der Diät, Erhöhung der Passagegeschwindigkeit, Beeinflussung des pH-Wertes (methanbildende Archaeen werden bei einem Pansen-pH von < 5,8 gehemmt), Lipid-Ergänzung – Details: 11, 13, 18, 24, 31, 32, 33).
Die sehr intensive Verabreichung zellwandarmer und stärkereicher Futtermittel, wie Getreide, widerspricht allerdings dem Grundprinzip einer wiederkäuergerechten Ernährung. Außerdem erfordern diese Futtermittel – im Gegensatz zur Weidehaltung – in der Regel einen höheren Einsatz fossiler Energie bereits bei ihrer Erzeugung und verursachen so einen stärkeren Kohlendioxidausstoß (14).
Eine weitere Möglichkeit sind verschiedene Fettquellen, die einen depressiven Einfluss auf methanogene Mikroorganismen haben. Aber auch hier existieren deutliche Einsatzgrenzen.
Der gezielte Einsatz von H2-Akzeptoren mit Energielieferungspotenzial für den Wiederkäuer (zum Beispiel Propionsäure-Vorstufen) bedarf noch weiterer wissenschaftlicher Studien (39).
All diese Möglichkeiten sind wissenschaftlich interessant, ihr methansenkendes Potenzial sollte jedoch nicht überbewertet werden, da das ruminale Mikrobiom sich auch selbst reguliert und gezielte Eingriffe oft nur temporär bleiben.
Neben den Bemühungen, die CH4-Bildung im Pansen durch Futterinhaltsstoffe oder die Rationsgestaltung zu reduzieren, wurde auch immer wieder versucht, sehr spezifische Futtermittelzusatzstoffe zu nutzen (Beispiele: Monensin oder auch Salze (49)).
Da seit Januar des Jahres 2006 EU-weit der Einsatz von Antibiotika als Futterzusatzstoffe nicht mehr gestattet ist und der langfristige intensive Einsatz von speziellen Salzen gesundheitsgefährdend ist, entfallen diese Möglichkeiten zur Reduzierung der CH4-Bildung aktuell im EU-Bereich.
Eine weitere Strategie, eine Reduktion der Methanbildung zu erreichen, wird in der Entwicklung von Impfstoffen für Wiederkäuer gesehen, um ihr Immunsystem zur Stimulierung von Antikörpern gegen Methan-produzierende Archaeen anzuregen (54).
Das Pansenepithel ist jedoch nicht sekretorisch. Daher verbleibt als möglicher Weg für die Antikörper die Speichelsekretion. Ein schwieriger Weg.
Ein weiterer Ansatz, um Antikörper in den Pansen zu verbringen, wäre eine "passive Immunisierung". So wurden Bakteriozine (proteinogene Toxine, die von Bakterienstämmen abgesondert werden) oder Bakteriozin-ähnliche Substanzen in bestimmten Stämmen von Butyrivibrio, Ruminococcus, Streptococcus oder Lactobacillus beobachtet. Einige der Bakteriozine scheinen hemmend auf Methanogene zu wirken.
Offen bleiben auch hier die Fragen nach einer Adaptation der Pansenmikrobiota innerhalb kurzer Zeit einschließlich der Möglichkeit einer speziesspezifischen Resistenzbildung und mögliche weitere Auswirkungen auf den Wirt.
Zwischenfazit: Es ist bisher nicht gelungen, einen geeigneten Impfstoff gegen Methan-produzierende Archaeen in wiederkäuenden Wirten zu produzieren.
Die Gesamtheit der Gene eines Organismus, egal ob Wirt oder Symbiont, stellt eine riesige Menge an Informationen dar.
Jedoch vergleichsweise nur wenige Gene werden ständig zur Aufrechterhaltung der Grundfunktionen einer lebenden Zelle benötigt. Ihre Aktivität wird reguliert, das heißt sie werden je nach Bedarf "an- oder abgeschaltet".
Als Transkriptom bezeichnet man die Gesamtheit der RNA-Moleküle einer Zelle (während eines bestimmten Entwicklungszustandes) als Produkte derjenigen Gensequenzen, die gerade "angeschaltet" sind ("RNA-Profil" – Details: (53)).
(44) haben erstmalig die methanogene Genaktivität auf Transkriptionsebene (bei Schafen) untersucht.
Sie nutzten zwei Schafgruppen (mit hoher und niedriger CH4-Emission bei gleicher Diät (ad libitum)). Die Differenz zwischen den beiden Gruppen war mit 4,41 Gramm CH4 pro Kilogramm TA signifikant verschieden.
Die Struktur der ruminalen mikrobiellen Gemeinschaft zwischen den beiden Schafgruppen erklärte nur einen geringen Teil der Emissionsunterschiede. Demgegenüber war die Genexpression der Methanogene deutlich mit der CH4-Emission gekoppelt. Für sieben von zehn enzymgesteuerten Schritten in der Methanogenese beobachteten (44) signifikante Zunahmen bezüglich der Häufigkeit der Transkripte je enzymverschlüsselndes Gen bei den hoch CH4-emittierenden Schafen.
Zwischenfazit: Es gibt erste Belege dafür, dass auch eine Genregulation der Methanogenese der Archaeen, möglicherweise durch das H2-Angebot im Pansen und/oder durch eine tierindividuelle Variation der Verweilzeit des Futters im Pansen gesteuert, von spezifischer Bedeutung ist.
In einer Studie von (37) wurde der Archaeol-Gehalt im Rinderkot von laktierenden Kühen analysiert. Archaeol (Di-O-phytanylglycerol) ist ein spezifisches Membranlipid von Archaeen, das auch im Rinderkot quantifiziert werden kann. Es stellt damit einen möglichen fäkalen Marker dar. Die Autoren (37) berichten überraschenderweise zusätzlich auch von positiven Beziehungen zwischen der Archaeol-Konzentration im Rinderkot und der individuellen CH4-Emission (g CH4/kg T-Aufnahme) bei Milchkühen.
Diese Ergebnisse bleiben kritisch zu hinterfragen, da bisherige Studien über mögliche Zusammenhänge zwischen der Gesamthäufigkeit von Archaeen im Pansen und der Methanproduktion (noch) sehr widersprüchlich sind.
In der Milchrinderzucht haben die in den vergangenen vier Jahrzehnten realisierten Leistungssteigerungen sowohl in Nordamerika als auch Westeuropa, in Verbindung mit einem immer intensiveren Einsatz von Kraftfutter und verbessertem Management, zu einer erheblichen Reduktion von Treibhausgasen je Kilogramm Milch geführt (5).
Aus globaler Sicht bietet die Leistungssteigerung noch genügend Reserven (15).
Beim gegenwärtigen Leistungsniveau in Deutschland bietet die weitere Leistungssteigerung genutzter Milchkühe jedoch nur noch begrenzte Möglichkeiten, indirekt den CH4-Anfall je Kilogramm Milch weiter zu reduzieren (Abbildung 4).
Aktuell wird intensiv an der Entwicklung von Verfahren gearbeitet, tierindividuelle Messungen des CH4-Outputs routinemäßig zu ermöglichen, da auch eine wirtspezifische erbliche Beteiligung an der CH4-Emission belegt werden konnte. Allerdings sind die diesbezüglich nachgewiesenen "indirekten" Heritabilitäten – verglichen mit denen von Produktionsmerkmalen (Milchmenge, Milchfettgehalt und andere) – nur gering (27, 40, 41). Auch deutet sich an, dass eine sehr intensive einseitige Selektion von Wiederkäuern auf den CH4-Output pro Kilogramm Trockenmasseaufnahme mit anatomisch-physiologischen Veränderungen im Gastrointestinalbereich, speziell im Vormagenbereich (Pansen), einschließlich der Passagerate einhergehen kann (16). Vor diesem Hintergrund sind züchterische Bestrebungen/Ansätze – bereits in der zugehörigen Grundlagenforschung – durch ergänzende tierärztliche Untersuchungen zu begleiten.
Tierschutzaspekte sollten ohnehin regelmäßiger Bestandteil vorgeschlagener CH4-Minderungsstrategien sein, wie zum Beispiel solche (neueren) Vorschläge zur routinemäßigen, überproportionalen Verfütterung von Salzen (Sulfate, Nitrate) erkennen lassen (49).
Die weitere Zuchtzielgestaltung bei Milchrindern mit dem Ziel der Reduzierung des CH4-Outputs pro Kilogramm Trockenmasseaufnahme (oder pro Produkteinheit) kann – unter Berücksichtigung der Machbarkeit und Kosten – wie folgt charakterisiert werden:
Die Etablierung einer zusätzlichen genetisch-züchterischen Selektion der Wirte (Wiederkäuer) auf den CH4-Output pro Kilogramm Trockenmasseaufnahme (oder pro Produkteinheit), wie häufig vereinfachend gefordert, ist äußerst komplex (Abbildung 6).
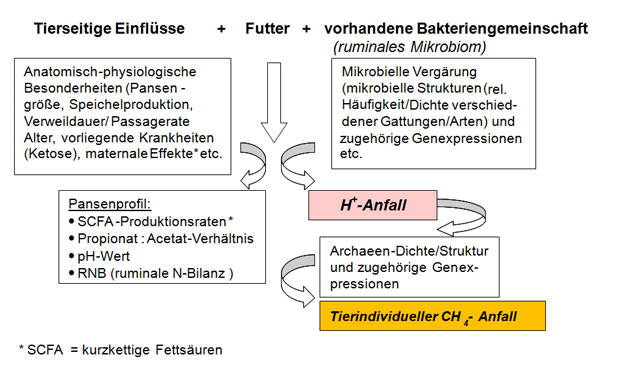
Abbildung 6: Tierindividueller CH4-Output in Abhängigkeit vom H+-Anfall unter besonderer Berücksichtigung vorhandener ruminaler Bakteriengemeinschaften.
Quelle: Eigene Grafik.
Anmerkung: Die mikrobielle Besiedelung des Intestinaltraktes des Neugeborenen beginnt bereits während des Geburtsvorgangs mit Keimen der Vaginal- und/oder Fäkalflora des Muttertieres.
Sie dürfte – nach aktuellem Kenntnisstand – somit eher als ergänzende Maßnahme zu verstehen sein, wenn andere indirekte Möglichkeiten bereits weitestgehend ausgeschöpft sind.
Zusätzlich existieren vielschichtige Interaktionen zwischen dem Wirt (Tier), seinem Pansenmikrobiom und dem verabreichten Futter, die bei einer möglichen Zuchtwertschätzung weiter berücksichtigt werden müssen.
Bezüglich der Einflussnahme auf die CH4-Bildung im Pansen ist weiter zu berücksichtigen, dass das ruminale Mikrobiom offensichtlich zum Teil selbst regulierend ist (Abschnitt 2.2).
Mit der Einführung neuer molekularbiologischer Methoden ist es nun möglich geworden, mikrobielle DNA aus dem Pansen zu extrahieren und direkt zum Beispiel über qPCR (quantitative Echtzeit-PCR (Polymerase-Kettenreaktion)) zu identifizieren und zu quantifizieren (44). Insbesondere die jüngste Entwicklung der schnellen und vollständigen Sequenzierung ganzer Genome erlaubt Einblicke in die Zusammensetzung und Wirkungsweise des Mikrobioms von bislang nicht gegebener Vollständigkeit (42, 44).
Obwohl unser Verständnis bezüglich der vielfältigen Mikrobiom x Fütterung x Wirt-Interaktionen noch relativ gering ist, haben verschiedene archaeelle Methanogene offensichtlich eine Vorliebe, unterschiedliche Substrate zu nutzen, die zusätzlich durch den Wirt und/oder die Fütterung modifiziert werden dürften (Tabelle 7).
| Tabelle 7: Effekte verschiedener Substrate auf das Wachstum ausgewählter archaeeller Methanogene | ||
|---|---|---|
| Getestete Methanogene; Spezies (Linie/Genotyp) | Substratkombination | beobachtetes Wachstum* |
Methanobrevibacter olleyae (229/11) | H2/CO2 | +++ |
| H2/CO2 + Acetat | ++ | |
| Methanobrevibacter smithii (R4C) | H2/CO2 | + |
| H2/CO2 + Acetat | + | |
| Methanobrevibacter ruminantium (M1) | H2/CO2 | - |
| H2/CO2 + Acetat | + bis +++ | |
| H2/CO2 + Formiat | ++ bis +++ | |
| H2/CO2 + Formiat + Methanol + Acetat | ++ bis +++ | |
| Methanospaera stadtmanae (MCB-3) | H2/CO2 | - |
| H2/CO2 + Acetat | - | |
| H2/CO2 + Formiat | - | |
| H2/CO2 + Methanol | +++ | |
| Methanospaera sp. (A4) | H2/CO2 | - |
| H2/CO2 + Acetat | - | |
| H2/CO2 + Acetat + Methanol | +++ | |
Quelle: (29, stark gekürzt).
Anmerkungen: * Bedeutung: +++ sehr gutes Wachstum, + wenig Wachstum, - kein Wachstum; Methanobrevibacter ruminantium (M1) wächst nicht in einem ausschließlichen H2/CO2-Substrat. Diese Species benötigt zusätzlich Acetat oder Formiat und wächst besonders, wenn gleichzeitig neben H2 und CO2 zusätzlich eine Kombination von Acetat, Formiat und Methanol vorhanden ist.
Doch auch bei einer gezielten Einflußnahme auf die Aktivitäten methanogener Archaeen stehen wir erst am Anfang, ihre Beeinflussung im Zusammenhang mit der Verfügbarkeit/Anfall von Wasserstoff (H2) bei der aneroben Gärung zu verstehen (44).
Aktuelle Forschungsaktivitäten lassen zukünftig auf neue Chancen hoffen, die archaeellen Methanogene direkt zu beeinflussen. Beim gegenwärtigen Kenntnisstand sind diese aber noch weit von einer praktischen Nutzung entfernt.
Das Verständnis der symbiotischen Beziehungen innerhalb des ruminalen Mikrobioms sowie zwischen Wirt und seinem ruminalen Mikrobiom ist ein wichtiger Schlüssel, um die Milch- und Fleischerzeugung immer effizienter und umweltgerechter zu gestalten.
Eine intensivere Grundlagenforschung zu dieser äußerst komplexen Thematik wäre auch in Deutschland wünschenswert.
Die genetische Ausstattung der Wiederkäuer beherbergt keine Gene, die eine eigene Methanbildung ermöglichen. Methan (CH4) wird durch methanogene Archaeen als "Nebenprodukt" vorrangig des mikrobiellen Kohlenhydrat-Abbaus unter anaeroben Bedingungen im Vormagensystem der Wiederkäuer (Wirte) produziert.
Es gibt genügend Hinweise, dass es auch eine wirtspezifische Komponente für variierende CH4-Emissionen bei Wiederkäuern gibt. Sie spiegeln sich in "indirekten Heritabilitäten" wieder.
Neue Methoden und Techniken zur schnellen und vollständigen Sequenzierung der Genome des Wirtes und der Mikroorganismen sowie zur Identifizierung und Quantifizierung ihrer Gene und Genprodukte einerseits und zur Bestimmung der CH4-Emissionen andererseits liefern neue Erkenntnisse über Zusammenhänge zwischen genetischen und physiologischen Eigenschaften des Wirtes, dem Mikrobiom und dem Fütterungsmanagement.
Mit der vorliegenden Übersichtsarbeit wird der aktuelle Kenntnisstand aus der Blickrichtung möglicher tierseitiger Einflussnahmen auf die CH4-Emission bei Wiederkäuern einschließlich deren Grenzen aufgezeigt.
The genetic make-up of ruminants contains no genes which would allow them to form methane on their own. Methane (CH4) is produced by methanogenic archaea as a by-product of microbial carbohydrate breakdown under anaerobic conditions in the forestomach system of ruminants (hosts).
There are numerous indications that there is a host-specific component for varying CH4 emissions in ruminants. They are reflected in the "indirect heritabilities".
New methods and techniques for the rapid and complete sequencing of the genomes of the host and of the microorganisms and to identify and quantify their genes and gene products provide further insight into the connections between genetic and physiological characteristics of the host, the microbiome and feeding management.
This publication presents the current state of knowledge regarding the influence of animal-related CH4 emissions in ruminants and includes a discussion of their possible limits.
La structure génétique des ruminants ne contient pas de gènes qui permettraient qu’ils forment de la méthane eux-mêmes. Le méthane (CH4) est produit par les archaeas méthanogènes en tant que sous-produit surtout de la dégradation microbielle de glucides sous des conditions anaerobes dans le système des pré-estomacs des ruminants (hôtes).
Quant aux émissions CH4 variables chez les ruminants, il y a assez d‘indicateurs qui suggèrent qu’il existe aussi une composante spécifique à l’hôte. Elles sont reflétées dans des « héritabilités indi-rectes ».
De nouvelles méthodes et techniques pour un séquençage rapide et complet des génomes du hôte et des microorganismes ainsi que pour l’identification et la quantification de leurs gènes et leurs produits géniques d’un côté et pour la détermination des émissions CH4 de l’autre fournissent de nouvelles connaissances sur les relations entre les caractéristiques génétiques et physiologiques du hôte, du microbiome et la gestion de l’alimentation animale.
Le présent travail illustre le niveau de connaissances sur une influence éventuelle que des facteurs liés aux animaux pourraient avoir sur les émissions CH4 des ruminants et il inclut une discussions de ses limites.
Prof. Dr. Wilfried Brade
TiHo Hannover
zurzeit: Leibniz-Institut (FBN) für Nutztierbiologie Dummerstorf
Wilhelm-Stahl-Allee 2
18196 Dummerstorf
Email: brade@fbn-dummerstorf.de
Prof. Dr. K. Wimmers
Leibniz-Institut (FBN) für Nutztierbiologie Dummerstorf
Institut für Genombiologie
Wilhelm-Stahl-Allee 2
18196 Dummerstorf