

Prof. Dr. Wilfried Brade (Hannover)
Die negative Energiebilanz (NEB) ist eine normale Anpassung der Milchkuh an die Energieabgabe bei Laktationsbeginn. Sie ermöglicht es hochleistenden Milchkühen, die maximale Leistung noch in der Phase einer NEB zu erreichen. Das bedeutet aber auch, dass das Ausmaß (Dauer, Intensität) der NEB in der Frühlaktation und das genetisch bedingte Milchleistungspotential eng korreliert sind (Abbildung 1).
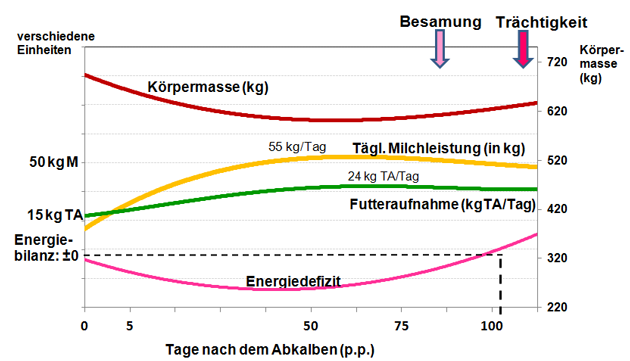
Abbildung 1: Bei hochleistenden Kühen steigt die Milchleistung nach der Geburt schneller als die Energieaufnahme über das Futter. Es entsteht eine negative Energiebilanz. Gleichzeitig verliert die Kuh deutlich an Körpermasse.
Quelle: Eigene schematische Darstellung in Anlehnung an (19).
Anmerkungen: M = tägliche Milchmenge; TA = tägliche Trockenmasseaufnahme (Futteraufnahme).
In späteren Laktationsabschnitten mit ausgeglichener oder positiver Energiebilanz (EB) ändern sich die Prioritäten der Energieverteilung wieder. Dies ist bei gesunden Milchkühen verbunden mit einer regelmäßigen Körpermassezunahme etwa ab Beginn des zweiten Laktationsdrittels.
Die konsequente Erhöhung der Milchleistung basierte bislang vorzugsweise auf einer Selektion nach hoher Einsatzleistung. Ungeachtet der begrenzten Futteraufnahmekapazität – speziell zu Beginn der Laktation – hat dies zu einer erheblichen Zunahme des Umfangs und der Dauer der NEB bei hochleistenden Milchkühen geführt (Abbildung 2).
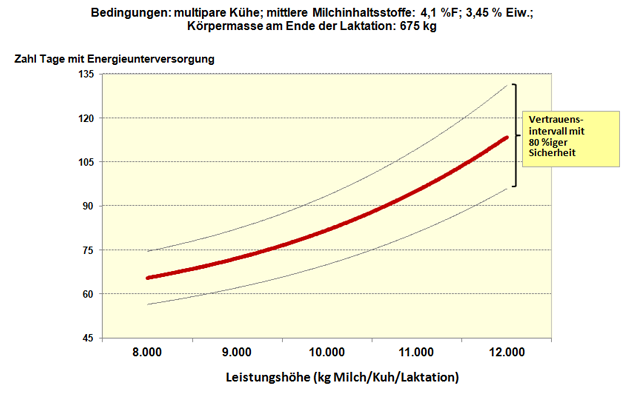
Abbildung 2: Zahl der Tage mit Energieunterversorgung in Abhängigkeit von der Leistungshöhe; Rationstyp: Grassilage bestimmt.
Quelle: Eigene Grafik.
Das Ausmaß und die Dauer der Körperfett- oder -proteinmobilisation hat einen entscheidenden Einfluss auf die Stoffwechselbelastung der Tiere und die daraus resultierende Stoffwechselgesundheit sowie das generelle Wohlbefinden hochleistender Kühe (5, 17, 25).
Die EB hochleistender Kühe weist zusätzlich eine genetische Komponente auf (Tabelle 1).
| Tabelle 1: Heritabilität (h2) und Wiederholbarkeit (r2) der Energiebilanz zu unterschiedlichen Zeitpunkten | ||||
|---|---|---|---|---|
| Kenngröße | Tage nach der Abkalbung | |||
| 50. | 100. | 200. | 305. | |
| Heritabilität, h2 | 0,06 | 0,06 | 0,04 | 0,13 |
| Wiederholbarkeit, r2 | 0,50 | 0,45 | 0,48 | 0,61 |
genetische Korrelation (rg) der Energiebilanz zum 50. Tag | 1,00 (identisch) | 0,78 | 0,18 | - 0,23 |
Quelle: (8).
Interessant ist, dass die genetischen Korrelationen (rg) für das Merkmal "Energiebilanz (EB)" – erfasst in differenzierten Laktationsstadien – deutlich verschieden sind, was darauf hindeutet, dass die EBen in der frühen und späten Laktation genetisch unabhängig sind (Tabelle 1).
Die hormonelle Konstellation bei Hochleistungskühen zu Laktationsbeginn kann wie folgt charakterisiert werden (3, 24,25):
Infolge der NEB in der Frühlaktation ist die Fettmobilisation post partum (p. p.) an einem höheren Niveau von langkettigen, nicht veresterten Fettsäuren (NEFA, englisch: not esterified fatty acids) im Blut deutlich zu charakterisieren (9, 17, 30).
Während der postpartalen NEB kommt es zu einem hormonell gesteuerten bevorzugten Nährstofffluss in das Euter. Eine Schlüsselrolle nimmt dabei Insulin ein (Abbildung 3). Die stark erniedrigte Insulinkonzentration löst einen "Glucosesparmechanismus" im insulinabhängigen Körpergewebe (Insulinresistenz) aus. Glucose wird nun verstärkt dem Euter zugeführt und dient dort unter anderem der Lactosesynthese (Abbildung 3).
Die Glucosebereitstellung bestimmt maßgeblich die Höhe der Lactosesynthese und damit die Milchmengenleistung. Während der Glucosebedarf in der Trockenstehperiode (etwa drei Wochen vor der Kalbung) bei etwa 800 bis 1000 Gramm pro Tag liegt, erhöht er sich bei einer Milchleistung von 45 Kilogramm pro Tag auf rund 3500 Gramm pro Tag (24). Ein Teil der Glucose wird deshalb auch (indirekt) aus Aminosäuren gebildet1.
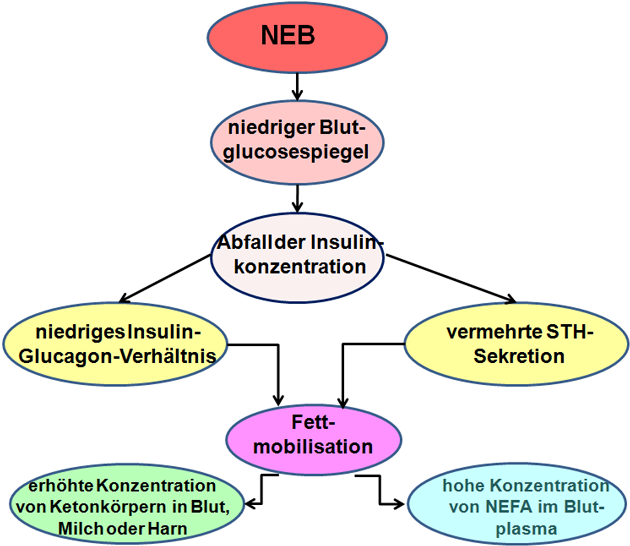
Abbildung 3: Schematische Zusammenstellung bestehender Zusammenhänge zwischen NEB und Fettmobilisation.
Quelle: Eigene Grafik erstellt in Anlehnung an (24).
Während der Mobilisierung von Körperfettreserven2 werden verstärkt NEFA in die Blutbahn abgegeben und gelangen so an die verschiedenen "Ziel"-Organe. Die Leber entnimmt NEFA aus der Blutbahn entsprechend dem Angebot3: Eine hohe NEFA-Konzentration im Blut bedeutet, dass auch eine erhöhte Menge an NEFA in die Leber gelangt. Dort wird das Überangebot in Form von Triglyceriden in den Leberzellen gespeichert (9, 17, 24, 25).
(22) belegen, dass die Konzentrationen von Glucose, Harnstoff oder Insulin im Blutplasma positiv mit der EB der Kuh korrelieren, während die Konzentrationen von NEFA oder β-Hydroxybutyrat (BHBA) im Blut negativ mit der EB korrelieren (Tabelle 2).
| Tabelle 2: Korrelationen (r) von ausgewählten Metaboliten im Blutplasma und der Energiebilanz* bei hochleistenden Holstein-Kühen** | ||
|---|---|---|
| Kenngröße/Merkmale | r | P |
| NEFA | - 0,685 | < 0,001 |
| Glucose | 0,456 | < 0,001 |
| β-Hydroxybutyrat | - 0,451 | < 0,001 |
| Harnstoff | 0,259 | < 0,001 |
Quelle: (22).
Anmerkungen: * 1. bis 10. Wochen p. p.; ** mittleres Leistungsniveau: 9.434 kg Milch in 305 Tagen.
Da wegen des Mangels an Glucose (oder Oxalacetat) in der Phase der NEB die Oxidation der NEFA gehemmt ist, steigt der Leberfettgehalt weiter an (9). Die Bildung von Ketonkörpern erhöht sich rasant. Das hat Auswirkungen auf die gluconeogenetische Kapazität und die Harnstoffsynthese. Die Stoffwechselsituation droht zu entgleisen (Abbildungen 4 und 5).
Auch hat bereits die Ernährung der hochtragenden Kuh während der Trockenstehperiode eine wichtige Bedeutung für das Ausmaß und die Dauer der Fettmobilisation sowie den erhöhten Gehalt an NEFA (9, 11, 30).
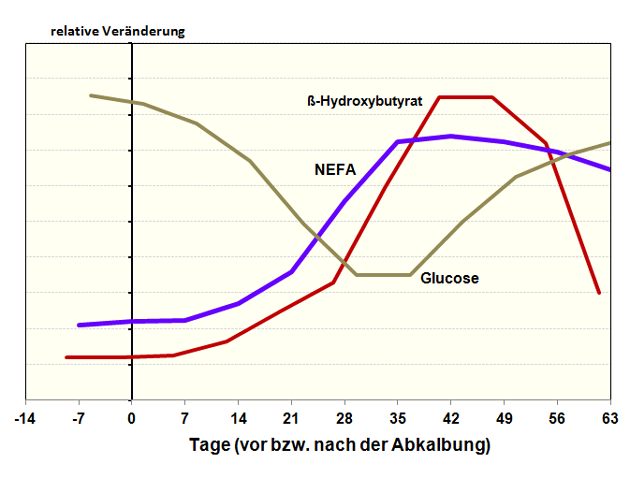
Abbildung 4: Schematische Darstellung der relativen Veränderung der Konzentrationen von Glucose, NEFA und Ketonkörper im Blut (in Anlehnung an (30)).
Quelle: Eigene Darstellung.
(11) belegen, dass die EB mit der NEFA-Konzentration im Blutplasma besser vorausgesagt werden kann als mit dem BHBA-Gehalt, sowohl für die Zeit pre partum als auch post partum. Zusätzlich muss an dieser Stelle vermerkt werden, dass die tierindividuelle Varianz, das heißt genetische Komponenten, beachtliche Unterschiede in der BHBA- und NEFA-Konzentration ausmachen können; trotz ähnlicher EB (14).
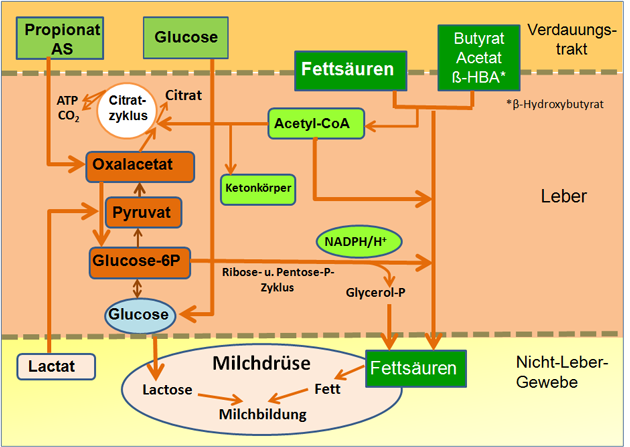
Abbildung 5: Vereinfachtes Schema des Nährstoffumsatzes bei der Milchkuh.
Anmerkung: Die aus dem Verdauungstrakt absorbierten langkettigen Fettsäuren umgehen den Leberstoffwechsel und gelangen direkt zur Milchdrüse. Dadurch wird die Synthese von Fettsäuren und folglich auch die dafür benötigte Glucosemenge reduziert. Die so eingesparte Glucose steht in der Milchdrüse für die Lactosesynthese zusätzlich zur Verfügung. Die Gluconeogenese ist bei Wiederkäuern bekanntermaßen die wichtigste Quelle der Glucosebereitstellung. Das dafür benötigte Oxalacetat wird aber auch für die Oxidation von Acetyl-CoA im Citratzyklus (TCA) benötigt. Fehlt es, kommt es zur Bildung von Ketonkörpern (31).
Um die Entstehung beispielsweise einer Ketose4 zu verhindern, kommt es auf zwei entscheidende Faktoren an (24):
Zusätzliche Beachtung erfordert die Proteinversorgung der Hochleistungskuh in der Phase der intensiven Mobilisation von Körpermasse (KM). Ein Kilogramm KM besitzt einen Energiegehalt von etwa 21 MJ NEL; sein Eiweißgehalt entspricht aber "nur" einem Äquivalent von 320 Gramm Rohprotein (24, 25). Mit anderen Worten: Aus einem Kilogramm mobilisierter KM kann die Kuh rund 7,2 kg Milch (aus energetischer Sicht), aber gleichzeitig nur 3,8 kg Milch aus Blickrichtung der Proteinbereitstellung bilden.
Die benötigten Proteine werden bevorzugt aus der Skelettmuskulatur mobilisiert. Eine intensive KM-Mobilisation geht mit einem Proteindefizit einher, das nun zusätzlich fütterungsseitig zu beachten bleibt.
Beispiel: Eine Kuh baut täglich etwa 1,6 kg KM in der fünften Laktationswoche ab. Dieser KM-Abbau liefert Energie für rund 11,5 kg Milch pro Tag; aber reicht "nur" für rund 6 kg Milch pro Tag hinsichtlich der Proteinbereitstellung. Etwa 460 g unabbaubares Futterprotein (UDP, engl.: undegradable protein) müssen der Kuh zusätzlich über die Ernährung bereitgestellt werden (das heißt 84 g UDP je kg "Milchdifferenz"), sollen die oben genannten 11,5 kg Milch pro Tag vollständig realisiert werden.
Sind die Körperreserven allerdings erschöpft und weist die Kuh gleichzeitig weiterhin ein deutliches Energiedefizit (zum Beispiel aufgrund einer unzureichenden TA) auf, sinkt die Milchleistung ebenso wie der Milchfett- und -eiweißgehalt drastisch ab.
Unter Ketonkörpern (auch Ketokörper genannt) fasst man Acetacetat (Acetoacetat), Aceton und BHBA zusammen. Letztere Verbindung ist bei Milchrindern die bedeutendste der drei. Diese Ketonkörper werden in der Leber gebildet (Abbildung 5).
Eine in der Phase einer NEB hormonell induzierte Lipolyse ist typisch für einen "Hungerstoffwechsel" (24). Ketonkörper entstehen, wenn das Abbauprodukt der Fettsäuren, Acetyl-CoA, aufgrund einer zu geringen Oxalacetatkonzentration nicht in den Citratzyklus eintreten kann (Abbildung 5).
(14) gruppierten Hochleistungskühe, die routinemäßig (zwei Wochen ante partum bis 14 Wochen post partum) permanent metabolisch überwacht wurden; im Nachhinein nach ihrer BHBA-Konzentration im Blutplasma. Kühe mit einer hohen BHBA-Konzentration in der Frühlaktation (BHBA+) mobilisierten erwartungsgemäß mehr Körpermasse. Sie hatten im Vergleich zu ihren Stallgefährtinnen mit geringerer BHBA-Konzentration im Blutplasma (BHBA-) eine höhere BCS-Abnahme, einen höheren Milchfettgehalt und ein höheres Fett-Eiweiß-Verhältnis (FEV) in der Milch. Eine deutliche Zunahme der NEFA-Werte im Blut (p. p.) war für beide Kuhgruppen zu beobachten. Die BHBA+-Tiere hatten jedoch über einen viel längeren Zeitraum einen stabil erhöhten NEFA-Gehalt im Blut als ihre BHBA--Stallgefährtinnen.
(15) ermittelten jüngst genetische Parameter für den BHBA-Gehalt in der Milch bei kanadischen Holstein-Jungkühen. Analysiert wurden die BHBA-Werte in der Milch aus Probegemelken zwischen dem fünften und 100. Tag (Tabelle 3).
| Tabelle 3: Genetische Korrelationen von BHBA und weiteren Kenngrößen bei Erstlaktierenden zu Beginn der Laktation (Kanadische Holsteins) | ||||
|---|---|---|---|---|
| Kenngröße | Kenngröße | |||
| BHBA | FEV | BCS | KET | |
| BHBA | h2 = 0,12 | 0,49 | - 0,35 | 0,48 |
| FEV | 0,49 | h2 = 0,12 | - 0,32 | 0,56 |
Quelle: (14).
Anmerkungen: BHBA = β-Hydroxybutyrat-Gehalt in der Milch am ersten Kontrolltag; KET = klinische Ketose.
Der BHBA-Gehalt in der Milch von Holstein-Jungkühen am ersten Testtag (MLP-Kontrolltag5) ist mit dem FEV in der Milch (0,49), der Körperkondition (BCS: - 0,35) und beobachteten Häufigkeit der klinische Ketose (0,48) signifikant korreliert (Tabelle 3).
Niedrigere BHBA-Werte bei Jungkühen in der Frühlaktation sind mit einer längeren Nutzungsdauer im Vergleich zu Stallgefährtinnen mit einer überdurchschnittlicher BHBA-Konzentration verbunden (15, 16).
Der BHBA-Gehalt in der Milch zu Beginn der Laktation, routinemäßig bei der MLP erfasst, könnte somit ein praktisches Werkzeug zur Erkennung solcher Kühe sein, die weniger anfällig für Hyperketonämie sind6 (Abbildung 6).
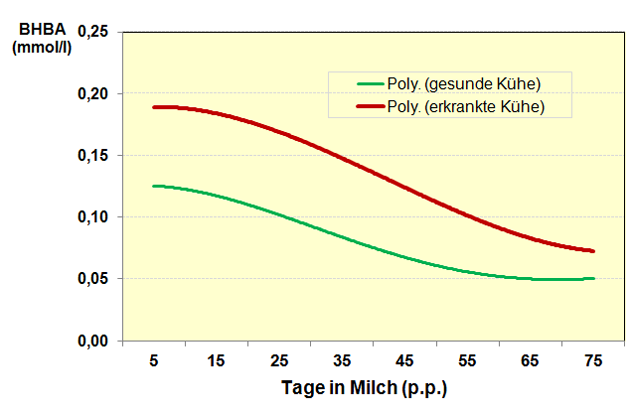
Abbildung 6: BHBA-Konzentration in der Milch bei gesunden und an Ketose erkrankten Kühen in Abhängigkeit vom Laktationsstadium.
Quelle: Grafik erstellt nach eigenen Berechnungen unter Verwendung der Angaben von (15).
Die Bewertung des BHBA-Gehaltes in der Frühlaktation besitzt eine Sensitivität von circa 70 Prozent, um eine vorliegende Hyperketonämie zu detektieren (15).
Zwischenfazit: Eine erhöhte Konzentration von Ketonkörpern in der Milch ist ein Hinweis für energetischen Stress und damit für eine intensive Mobilisation von Körpergewebe in der frühen Laktation.
Zu Beginn der Laktation ist das FEV am höchsten. Der Übertritt in eine positive Energiebilanz erfolgt bei Hochleistungskühen oft erst nach dem 80. Laktationstag (Abbildung 1). Der zu Laktationsbeginn stark erhöhte Fettgehalt der Milch sinkt mit dem Ansteigen der Milchleistung schnell ab und erreicht zum Laktationsgipfel seinen Tiefpunkt.
Bereits (10), aber auch (22) zeigen, dass das FEV in der Milch negativ mit der Energiebilanz korreliert ist (Tabelle 4).
(12) bewerten das FEV als einen geeigneteren Indikator für eine NEB in der Frühlaktation als vergleichsweise die Ketonkörperkonzentration in Milch. Dies stimmt mit Aussagen von (22) überein (Tabelle 4).
| Tabelle 4: Korrelationen (r) von ausgewählten Merkmalen in der Milch und der Energiebilanz* bei hochleistenden Holstein-Kühen** | ||
|---|---|---|
| Kenngröße/Merkmale | r | P |
| Fett/Lactose-Verhältnis (FLV) | - 0,589 | < 0,001 |
| Fett/Eiweiß-Verhältnis (FEV) | - 04,96 | < 0,001 |
| Milch-Azetongehalt | - 0,410 | < 0,001 |
| Harnstoff | 0,103 | 0,002 |
Quelle: (22).
Anmerkungen: * 1. bis 10. Woche p. p.; ** mittleres Leistungsniveau: 9.434 kg Milch in 305 Tagen.
Die enorme Bedeutung des Zeitpunktes der Erfassung des FEVs in Abhängigkeit vom Laktationsbeginn zeigen auch (6). Eine genügend enge negative Beziehung zwischen FEV und EB ist vor allem in der Frühlaktationsphase zu nennen (Abbildung 7).
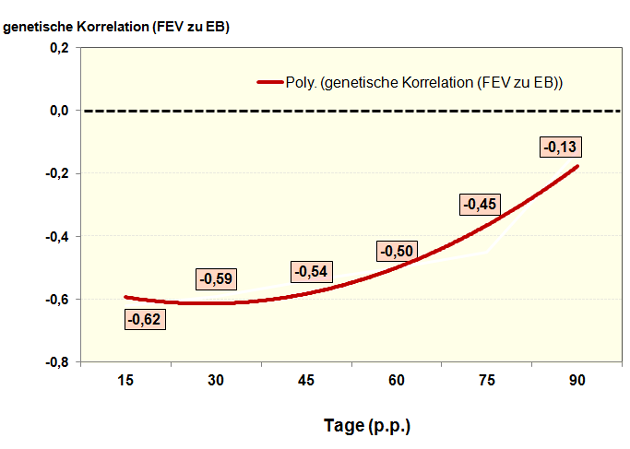
Abbildung 7: Genetische Korrelationen zwischen dem Fett-Eiweiß-Verhältnis (FEV) und der Energiebilanz (EB) bei Jungkühen in Abhängigkeit vom Laktationsstatium.
Quelle: Eigene Darstellung (6).
Während ein FEV ≥ 1,5 für eine verstärkte Fettmobilisation spricht, ist ein FEV < 1 Ausdruck für einen starken Abfall des Milchfettgehaltes wie er bei Verfütterung einer strukturarmen, kohlenhydratreichen Ration oder bei Erschöpfung der Körperfettdepots beobachtet werden kann (26).
Die Höhe des Eiweißgehaltes zur Zeit des Laktationsgipfels wird zusätzlich vom Niveau der mikrobiellen Proteinsynthese, dem Angebot an Durchflussprotein und leicht verfügbaren Kohlenhydraten bestimmt (11).
(29) prüften die Aussagefähigkeit des FEVs etwa eine Woche nach der Abkalbung. Ausgewertet wurden rund 1500 italienische Holstein-Kühe. Am siebten Tag (p. p.) wurde gezielt eine Milchprobe gezogen und das FEV in der Milch bestimmt. Tiere mit einem FEV ≥ 2,0 (siebter Tag (p. p.)) zeigten eine zunehmende Krankheitshäufigkeit. (12) berichten demgegenüber bereits bei einem FEV > 1,5 (allerdings "erst" im Mittel am 18. Tag (p. p.) erfasst) über ein größeres Krankheitsrisiko.
Zwischenfazit: Ein FEV > 1,5 weist nur in den ersten Wochen nach der Abkalbung eine moderate Beziehung zur EB auf. Niedrige Werte in Hochleistungsherden sind mit Vorsicht zu interpretieren, da FEVe < 1 eher auf eine ungenügende Versorgung mit strukturwirksamer Rohfaser (Acidose) hinweisen (26, 28).
Milchfett ist äußerst komplex zusammengesetzt und besteht aus mehr als 400 verschiedenen Fettsäuren (FS). Die meisten FS sind jedoch nur in Spuren vorhanden (1). Nur etwa ein Dutzend FS sind quantitativ bestimmend; vor allem gesättigte Fettsäuren. Besonders hoch ist der Anteil der langkettigen, gesättigten Palmitinsäure (C16:07) (Tabelle 5).
| Tabelle 5: Fettsäuremuster (FS-Muster) im Milchfett bei Holstein-Kühen | |
|---|---|
| Merkmal/FS-Muster | Mittelwert (g FS/100 g FS) |
| gesättigte FS (engl. SFA) | 67,2 |
| ungesättigte FS (engl. MUFA) | 29,7 |
| mehrfach ungesättigte FS (engl. PUFA) | 2,9 |
| gesättigte FS: C6:0 bis C14:0 | 19,6 |
| C16:0 (Palmitinsäure) | 29,0 |
| C18:0 (Stearinsäure) | 12,2 |
| C18:1 | 26,4 |
| C18:2 | 2,8 |
Quelle: (4).
Allerdings haben zahlreiche weitere Faktoren wie die Fütterung, das Laktationsstadium oder die Rasse der Milchkuh erhebliche Auswirkungen auf den Fettgehalt und damit auf die FS-Zusammensetzung der Milch (Abbildung 8).
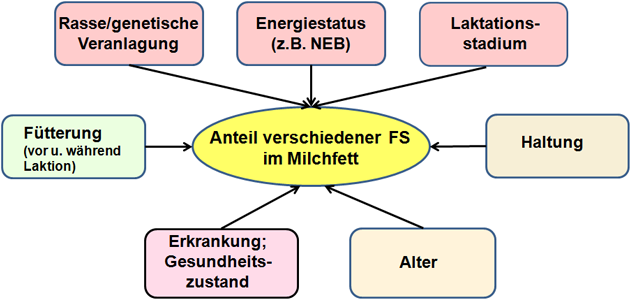
Abbildung 8: Wichtige Einflussfaktoren auf die Milchfettzusammensetzung.
Quelle: Eigene Grafik.
Das FS-Profil im Milchfett ist zusätzlich von der EB der Milchkuh und weiteren physiologischen Kenngrößen abhängig (Abbildung 8).
Die Milch-FS stammen aus zwei Quellen (1):
Substrate für die de novo Synthese sind vor allem Acetat und ß-Hydroxybutyrat aus der Fermentation im Pansen. Sie werden vorrangig zur Synthese von kurz- und mittelkettigen FS (C4:0 bis C14:0) einschließlich eines Teil der C16:0 in den Euterepithelzellen genutzt (1). Der Rest der C16:0 und weitere FS entstehen im Euter aus zirkulierenden langkettigen FS, die aus der Resorption aus dem Verdauungstrakt und/oder der Mobilisierung von Körperfettreserven stammen (1, 2).
(7) haben die FS-Zusammensetzung im Milchfett von Holstein-Kühen in Abhängigkeit von der EB der laktierenden Kühe detailliert untersucht (Tabelle 6).
| Tabelle 6: Effekt der negativen Energiebilanz (NEB) auf den Anteil verschiedener Fettsäuren (FS) im Milchfett bei Holstein-Kühen | ||||
|---|---|---|---|---|
| Faktor* | gesättigte FS (engl. SFA) | ungesättigte FS (engl. UFA) | ||
| HCFA** (in Prozent) | VFA (in Prozent) | MUFA (in Prozent) | PUFA (in Prozent) | |
| in der NEB-Phase | 43,5 | 17,7 | 22,6 | 3,6 |
| nach Überwindung der NEB | 41,7 | 23,6 | 20,8 | 3,8 |
Quelle: (7).
Anmerkungen: * Laktationszeitraum: siebter Tag bis 17. Woche p. p.; ** hier (in Anlehnung an (7)): HCFA = Hypercholesterinämie fördernde FS (C12:0, C14:0; C16:0); VFA = volatile FS; MUFA= einfach ungesättigte FS; PUFA= mehrfach ungesättigte FS.
Nachzutragen bleibt an dieser Stelle: Die Wirkung der gesättigten FS auf den humanen Cholesterinspiegel ist unterschiedlich8.
Die Laurin- (C12:0), Myristin- (C14:0) und Palmitinsäure (C16:0) bewirken vorrangig eine Erhöhung des Gesamtcholesterinniveaus beim Menschen. Gleichzeitig zeigte sich, dass Laurin-, Myristin- und Palmitinsäure auch zu einer Änderung des LDL:HDL-Verhältnisses beim Verbraucher (Mensch) beitragen können (1, 20, 32).
Der Anteil (in Prozent) der gesättigten FS (saturated fatty acids, SFA), die eine Bildung von Cholesterin fördern (Hypercholesterinämie), die sogenannten HCFA9, wurden getrennt von den flüchtigen FS (volatile fatty acids, VFA) sowie einfach ungesättigten FS (monounsaturated fatty acids, MUFA) oder mehrfach ungesättigten FS (polyunsaturated fatty acids, PUFA) analysiert (Tabelle 6).
Kühe in der NEB haben einen geringfügig höheren Anteil ungesättigter FS, aber auch einen deutlich erhöhten Gehalt an unerwünschten HCFA in ihrer Milch (Tabelle 6).
Bereits (28) zeigen, dass bei Kühen in der Phase der NEB die Anteile der gesättigten FS C16:0 und C18:0 erhöht sind. Gleichzeitig belegen sie, dass bei Kühen mit einer Milchfettdepression (FEV ≤ 1,05) in der Regel gestiegene CLA-Anteile10 im Milchfett zu beobachten sind – ein Hinweis auf physiologische Störungen, unvollständige Biohydrierung bereits im Pansen und/oder einer vorliegenden Acidose.
Der Studie von (13) ist zusätzlich zu entnehmen, dass auch der Anteil der Ölsäure (C18:1-cis-9) im Milchfett in einer signifikanten Beziehung zur NEFA-Konzentration im Blutplasma der laktierenden Kühe in der Frühlaktation steht (r2 = 0,38). Sie schlussfolgern, dass der C18:1-cis-9-Anteil im Milchfett ein weiterer Biomarker zur Frühwarnung besonders gefährdeter Milchkühe hinsichtlich ihres metabolischen Status ist. Sie empfehlen eine Bewertung der C18:1-cis-9-Konzentration in der Milch speziell in der zweiten Laktationswoche, um eine selektive Behandlung gefährdeter Kühe frühzeitig vornehmen zu können (13).
Zwischenfazit: Bei verstärkter Nutzung von Körperfettdepots zur Milchbildung verschiebt sich das FS-Verhältnis der gesättigten Fettsäuren; der Gehalt an Ölsäure im Milchfett nimmt zu. Ausgewählte Milchfettsäuren korrelieren mit einer Zunahme von NEFA im Blutplasma laktierender Kühe.
Für einen selektiven und sensitiven Nachweis von Milchinhaltsstoffen (exakter: Stoffgruppen) kommt dem mittleren Infrarotlichtbereich wachsende Bedeutung zu, da die meisten Moleküle charakteristische Absorptionsbanden in dieser Wellenlängenregion aufweisen (27).
Alle Landeskontrollverbände (LKV) setzen bei der Analyse von Milchproben (zum Beispiel Bestimmung der Milchfett- oder Milchharnstoffgehalte) bereits entsprechende Geräte ein.
Jüngste Studien von (18) belegen nun auch die Möglichkeit, die EB von Milchkühen auf Basis von MIR-Spektren in der Milch routinemäßig zu erfassen (Abbildung 9).
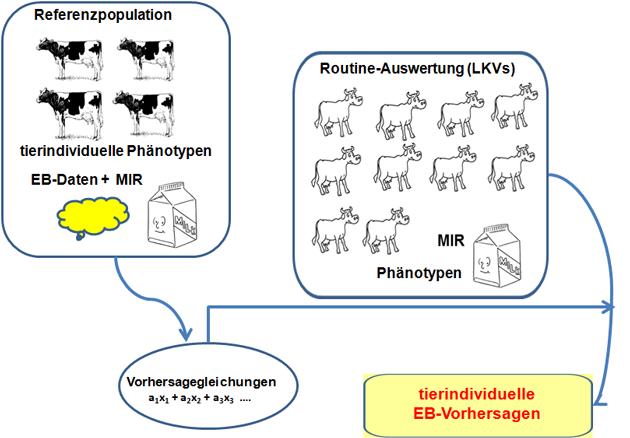
Abbildung 9: Nutzung von MIR-Daten aus der Milchleistungsprüfung (MLP) zur tierindividuellen Erfassung der EB in praxi.
Quelle: Eigene Darstellung.
Tierindividuelle EBen, erfasst auf der Basis von MIR-Spektren in der Milch, sind wiederholbar und besitzen zu den tatsächlich vorliegenden EBen eine signifikante Beziehung (rg = 0,54). Die zugehörige Heritabilität (Erblichkeit, h2) ist jedoch deutlich geringer als für Produktionsmerkmale (Tabelle 7). Gleichzeitig werden negative Beziehungen zur Milchmengenleistung und positive Beziehungen zur Körperkonditionsänderung (ΔBCS) im Laktationsverlauf beschrieben. Dies entspricht der Erwartung.
| Tabelle 7: Ermittelte Parameter für die geschätzte Energiebilanz mittels Milch-MIR im Laktationsverlauf* | |||||
|---|---|---|---|---|---|
| Kenngröße | Heritabilität (h2) | genetische Korrelation (rg) zwischen gemessener und mittels MIR vorhergesagter EB | genetische Korrelationen (rg) zu weiteren Merkmalen | ||
| Milchmenge | Fett in Prozent | ΔBCS** | |||
| EB (MJ/d) | 0,10 | 0,54 | - 0,29 | + 0,17 | 0,45 |
Quelle: (18).
Anmerkungen: * Datenbasis: 1.102 Irische Holstein-Kühe; ** ΔBCS = Änderung der Körperkondition (BCS-Noten) im Laktationsverlauf.
(18) fassen die bisherigen Ergebnisse zusammen, spezielle FS in der Milch mittels des Infrarotlichtbereiches in Milchproben routinemäßig zu bewerten. Auch dies sollte bei Bedarf gut möglich sein.
Zwischenfazit: MIR-Spektren der Milch können zur Bewertung der tierindividuellen EB eingesetzt werden. Gleichzeitig könnten sie zukünftig ein Benchmark zur Bewertung von Herden/Betrieben zwecks Betriebsberatung(-kontrolle) bei fehlenden Details zu Fütterung/Management werden. Die tierindividuelle Genauigkeit bleibt vorerst begrenzt. Bei Bewertung größerer Töchtergruppen von Besamungsbullen sollte sich die Zuverlässigkeit der MIR-Daten jedoch erhöhen und diesbezüglich negative Vererber sicher erkennen lassen.
Die hochleistende Milchkuh deckt ihren Nährstoff- und Energiebedarf regelmäßig über:
Die T-Aufnahme ist der Eckpfeiler einer maximalen und effizienten Milchleistung, denn nur Kühe, die in der Lage sind, große Mengen Futter zu fressen, erreichen auch eine hohe Milchleistung über viele Laktationen.
Der Stoffwechsel der Milchkuh ist zu Laktationsbeginn durch Umschaltung auf die vermehrte Oxidation langkettiger Fettsäuren (NEFA) aus dem Depotfett und von Ketonkörpern aus der Leber sowie durch eine verminderte Oxidation von Glucose und Aminosäuren gekennzeichnet (9, 17, 22, 25).
Im Hinblick auf eine Reduktion der metabolischen Belastung von Hochleistungskühen wäre die routinemäßige Erfassung von (täglichen) Energiebilanzen sowohl von tierärztlichem als auch züchterischem Interesse.
In der Phase einer NEB verschlechtern sich sowohl die guten diätetischen Eigenschaften des Milchfettes für die menschliche Ernährung als auch die industriellen Verarbeitungseigenschaften der Rohmilch.
Das Verhindern einer weiteren Ausdehnung der NEB bei hochleistenden Milchkühen, die aktuell bereits fast das gesamte erste Laktationsdrittel umfasst (Abbildung 2), ist deshalb auch vor diesem Hintergrund neu zu bewerten.
Die Milch enthält natürlicherweise wertvolle Biomarker, da sie als Sekret der Milchdrüse regelmäßig auch Substanzen aus dem Blutplasma enthält. Sie weist ein einzigartiges Spektrum verschiedenster Stoffe auf. So kommen in der Milch etwa 60 Enzyme originär vor. Die Bedeutung von Milch oder Milchprodukten als Ca-Quelle ist unbestritten. Lactose ist nicht nur ein Energieträger in der Milch, sondern fördert auch die Absorption von Ca und weiteren Mineralstoffen. Viele ernährungsphysiologisch vorteilhafte Wirkungen der Milch können dem Milchprotein zugeordnet werden.
Milchfett enthält eine Vielzahl verschiedenster Fettsäuren. Milchfett ist besonders reich an langkettigen gesättigten Fettsäuren. Es besteht aber auch zu etwa 25 Prozent aus Ölsäure sowie zu etwa zehn Prozent aus kurz- oder mittelkettigen gesättigten Fettsäuren (wie Butter-, Capron- und Caprinsäure).
Zahlreiche Milchbestandteile reflektieren – wenn auch zum Teil nur zeitlich begrenzt – die NEB einer Milchkuh und eine damit verbundene differenzierte Nutzung von Körperfettreserven zu unterschiedlichen Zeitpunkten (2, 10, 13, 15).
Das FEV in der Milch der Frühlaktation in Verbindung mit der Bestimmung von Ketonkörpern, vor allem der BHBA-Konzentration – zusätzlich ergänzt durch die Erfassung des Anteils einiger ausgewählter FS im Milchfett (speziell der Öl- sowie der Myristinsäure) – bietet sich hier an (Abbildung 10).
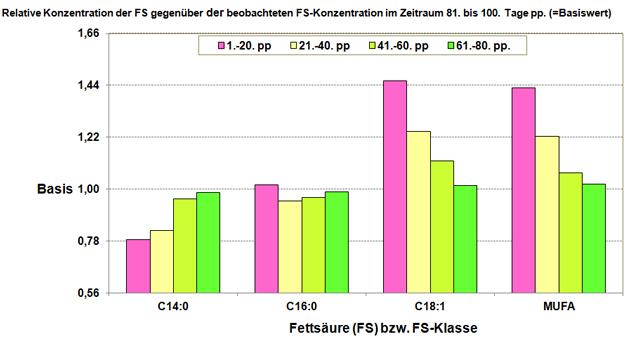
Abbildung 10: Relative FS-Konzentrationen in verschiedenen Zeiträumen nach der Abkalbung im Vergleich zur zugehörigen Konzentration der FS (FS-Klasse) im Zeitraum 81. bis 100. Tag p. p..
Quelle: Eigene Darstellung in Anlehnung an (2).
Anmerkung: MUFA = einfach ungesättigte FS.
Besonders empfehlenswert wäre ihre routinemäßige Bewertung etwa sieben und circa 21 Tage nach der Abkalbung. Dies dürfte jedoch selten in praxi möglich sein.
Aus Sicht des Arbeits- und Kostenaufwands wäre (vereinfacht) auch die regelmäßige Bewertung der ersten und zweiten Milchprobe (nach Abkalbung) bei der MLP denkbar. Allerdings sind dann größere und stark variierende Zeitspannen zwischen Laktationsbeginn und der Probenahme (bis circa 56 Tage) zu akzeptieren und zusätzlich rechnerisch zu korrigieren. Dies bedeutet wiederum einen erheblichen Informationsverlust insbesondere für das Einzeltier.
Diese MLP-Informationen sind gut geeignet, größere Bullennachzuchten in verschiedenen Herden und/oder spezielle Kuhgruppen (regelmäßige Bewertung der "Frischabkalber") innerhalb einer (größeren) Herde permanent zu erfassen; letzteres bezüglich eines spezifischen Herdenmonitorings ("Benchmark" für die Herdenüberwachung).
Wir stehen erst am Anfang, ausgewählte Milchbestandteile gezielt zur Bewertung des Energiestresses von hochleistenden Milchkühen routinemäßig in praxi zu nutzen.
Große Erwartungen werden deshalb auf internationale Projekte (zum Beispiel RobustMilk, OptiMIR) gesetzt, die längst, vor allem im Ausland, angeschoben wurden (21, 23).
Kurz vor der Kalbung und mit beginnender Laktation befindet sich die hochleistende Milchkuh (individuell unterschiedlich lange) in einer negativen Energiebilanz (NEB). In dieser Phase sind Milchkühe in der Lage, Körperfett- und Körperproteinreserven für die Milchbildung heranzuziehen. Diese Eigenschaft ist keineswegs pathologisch, sondern eine genetisch determinierte Strategie, mit deren Hilfe die Stoffwechselleistung laktierender Muttertiere gesteigert werden kann. Die Strategie bleibt jedoch nicht ohne Risiko für die laktierende Hochleistungskuh, da sich leicht auch Störungen – vor allem des Lipidstoffwechsels – bei einer erheblichen NEB einstellen können.
Das Vermeiden unerwünschter Entwicklungen als Folge der NEB in der Frühlaktation – sowohl im Hinblick auf deren Ausmaß und als auch Dauer – erfordert deshalb eine konsequente Beachtung dieses Merkmals bereits im Zuchtziel, speziell bei Holsteins.
Von besonderem Interesse sind leicht zugängliche Marker zur routinemäßigen Bewertung des Energiestatus hochleistender Milchkühe. Hier bieten sich zunehmend ausgewählte Milchbestandteile an.
In der vorliegenden Arbeit werden solche Milchbestandteile aufgezeigt und bewertet, die als mögliche Marker für die Energiebilanz (EB) bei hochleistenden Milchkühen in der Frühlaktation (zukünftig) von weiterem Interesse sein dürften.
Shortly before calving and with incipient lactation, high-yielding dairy cows undergo (individually varying) periods of negative energy balance (NEB).
At this stage, dairy cows are able to use body fat and protein reserves for milk production. This property is not pathological but a genetically determined strategy to increase the metabolic performance of lactating cows. Yet, it is not without risk for lactating high-yielding dairy cows, as metabolic disorders – especially within the lipid metabolism – can occur in cases of NEB. To avoid any adverse effects resulting from NEB in early lactation – in terms of both NEB extent and duration – this feature needs to be taken into account consistently already where and when breeding goals are concerned, especially in case of Holsteins.
Easily accessible markers are of particular interest for the routine evaluation of the energy status of high-producing dairy cows. Selected milk components are of particular convenience in this context.
The paper at hand aims at pointing out and assessing those components which could be of (future) interest as markers for the energy balance (EB) during early lactation of high-producing dairy cows.
Peu de temps avant le vêlage et au début de la lactation, la grande laitière traverse une période de bilan énergétique négatif (BEN). Pendant cette période, les vaches laitières sont capables de produire du lait grace à leurs réserves de graisse et de protéine. Cette capacité n’est pas du tout pathologique sinon une stratégie, génétiquement déterminée, pour augmenter la performance métabolique. Mais cette stratégie n’est pas sans risque pour la grande laitière en période de lactation car un BEN prononcé peut causer des irritations – surtout en ce qui concerne le métabolisme lipidique.
Pour éviter des effets indésirables à cause d’un BEN au début de la lactation – en vue et de leur étendu et de leur durée –, cette caractéristique devra être constamment prise en considération déjà dans le cadre du but de l’élevage.
Les marqueurs facilement accessibles sont d’un intérêt particulier pour l’évaluation routine du status d’énergie des grandes laitières, surtout pour les Holsteins.
Ce sont les composants de lait sélectionnés qui s’y offrent de plus en plus.
1 Sogenannte glucogene Aminosäuren (auch glucoplastische Aminosäuren genannt) können für die Glucose-Neubildung herangezogen werden. Beim Abbau glucogener Aminosäuren entstehen entweder Pyruvat, das dann in die Gluconeogenese einfließt, oder auch Zwischenprodukte des Citratzyklus. Bekannte glucogene Aminosäuren sind unter anderem Glycin, Cystein oder Valin.
2 Je fett- oder energiereicher die Körperdepots der Milchkühe (p. p.) sind, umso höher ist die (theoretisch) mögliche Energiebereitstellung je Kilogramm Substanzabbau. Andererseits ist bei zu fetten Tieren – infolge der gleichzeitig relativ geringeren Futteraufnahme – auch mit einer erhöhten Mobilisation von Körpersubstanz und damit einer verstärkten Neigung zu Stoffwechselstörungen zu rechnen (9, 26).
3 Die Höhe der NEFA-Konzentration im Blutplasma ist abhängig vom Ausmaß der Lipolysereaktion.
4 Ketose (Acetonämie) ist eine Stoffwechselstörung, die vor allem bei Hochleistungskühen auftritt, die sich in einer negativen Energiebilanz befinden (25, 26).
5 MLP = Milchleistungsprüfung.
6 Der Referenztest zur Diagnostik einer Hyperketonämie ist die Bestimmung der Konzentration an BHBA im Blut. Dieses Probenahmeverfahren ist jedoch nicht für die routinemäßige züchterische Bewertung (zum Beispiel von großen Bullennachzuchten) geeignet.
7 Erläuterung zur Definition der FS: Zahl der C-Atome:Doppelbindungen. Fettsäuren werden sinnvollerweise durch die Anzahl der C-Atome (Kettenlänge) und die Anzahl und Position von Doppelbindungen charakterisiert. So kann man Fettsäuren aufgrund ihrer Kettenlänge in kurz-, mittel- und langkettige Fettsäuren einteilen. Kurzkettige Fettsäuren besitzen vier bis sechs C-Atome, mittelkettige acht bis zwölf und langkettige Fettsäuren besitzen vierzehn bis vierundzwanzig C-Atome.
8 Jede Fettsäure sollte korrekterweise einzeln betrachtet werden. Myristin- und Palmitinsäure haben eine ausgeprägte LDL‐Cholesterin-steigernde Wirkung. Die Zunahme des Verhältnisses Gesamtcholesterin/HDL‐Cholesterin – ein Maß für das kardiovaskuläre Risiko in der Humanmedizin – ist bei Palmitinsäure am deutlichsten (siehe auch Literaturangaben).
9 Engl.: hypercholesterolemic fatty acids (HCFA).
10 Konjugierte Linolsäuren (CLA).
Prof. Dr. Wilfried Brade
Tierärztliche Hochschule Hannover (TiHo)
zurzeit (Gast): Leibniz-Institut für Nutztierbiologie Dummerstorf (FBN)
Wilhelm-Stahl-Allee 2
18196 Dummerstorf
Email: brade@fbn-dummerstorf.de