

von Prof. Dr. Wilfried Brade (Hannover/Dummerstorf) und Prof. Dr. Ottmar Distl (Hannover)
Der Pansen ist eine offene Fermentationskammer, in der der Wirt (Wiederkäuer) eine symbiotische Beziehung mit seinem sehr komplexen Mikrobiom eingeht.
Der Wirt und sein Pansenmikrobiom sind zwei wechselseitig abhängige Komponenten, die während der gemeinsamen Koevolution in Millionen von Jahren entstanden sind. Diese Symbiose bietet bessere Chancen des beidseitigen Überlebens. Erst die zahlreichen Symbionten im Pansen geben dem Wiederkäuer die Fähigkeit, faserreiches Futter zu nutzen, das nicht für den menschlichen Verzehr geeignet ist.
Wie jedes symbiotische Ökosystem in einem Verdauungstrakt unterliegt auch das Pansenmikrobiom deutlichen Einflüssen des Wirtes sowie seiner Fütterung.
Das Pansenmikrobiom selbst ist zusätzlich reich an vielfältigen Interaktionen zwischen seinen "Community-Mitgliedern", wie die komplexe Zusammenarbeit beim Abbau der Nährstoffe, vorhandene Zell-Zell-Signale oder der gemeinsame Aufbau von "Biofilmen" erkennen lassen. Ein wesentlicher Akteur in dieser komplexen mikrobiellen Gemeinschaft sind Archaeen.
Spezifische methanogene Archaea können aus Kohlendioxid (CO2) und Wasserstoff (H2) Methan (CH4) bilden. Sie senken somit den Wasserstoff-Partialdruck im Pansen und verhindern damit gleichzeitig eine übermäßig schnelle Bildung von Milchsäure.
Das Verständnis sowohl der physiologischen Beziehungen des Wirts und seines Mikrobioms als auch der speziesspezifischen Beziehungen innerhalb des Mikrobioms ist maßgeblich für die weitere Verbesserung der Produktionseffizienz der Rinder und einer gleichzeitig angestrebten Verbesserung der Umweltfreundlichkeit der Rinderproduktion.
Archaeen (lat.: Archaea), früher oft auch Archebakterien genannt, gehören zu einer der drei Domänen des Lebens (1).
Archaeen sind einzellige Organismen und werden, wie die Bakterien, zu den Prokaryoten gezählt. Ihre separate Stellung resultiert aus ihren speziellen physiologisch-biochemischen, genetischen1 sowie strukturellen Merkmalen. So belegt bereits der Aufbau ihrer Zellwand deutliche Unterschiede zu den anderen Domänen.
Besonders interessant ist ihr ungewöhnlicher Stoffwechsel (Abbildung 1). Eine Besonderheit des archaeellen Stoffwechsels ist ihre Methanbildung (Methanogenese) der sogenannten Methanogenen (Methan(CH4)-produzierende Archaeen).
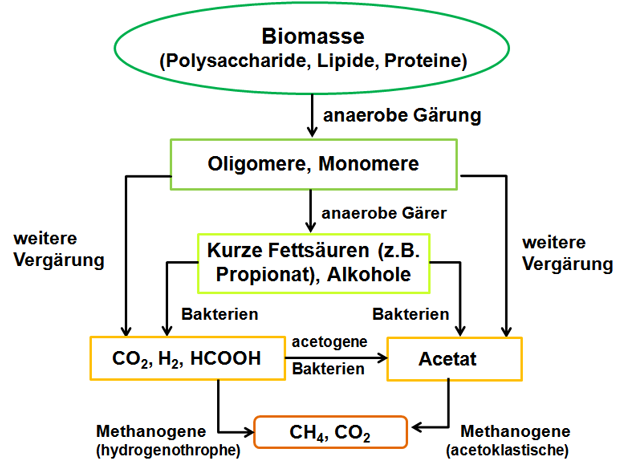
Abbildung 1: Schematische Darstellung der anaeroben Verdauung von Biomasse mit abschließender Methanbildung durch archaeelle Methanogene
Quelle: Eigene Darstellung.
Zusätzlich sind zahlreiche extremophile Archaeen in der Lage, spezielle Habitate zu nutzen (zum Beispiel hyperthermophile Archaeen in Habitaten mit sehr hohen Temperaturen (≥ 80° C) oder die acidophilen Arten in Habitaten mit sehr niedrigen pH-Werten).
Methanbildner findet man in sehr differenzierten anaeroben Habitaten, in denen ein Abbau von Biomasse stattfindet (Reisfelder, Biogasanlagen, im Darm von Monogastriden, im Mund (Zahnflora) des Menschen und anderes). Der Pansen von Wiederkäuern ist ein wohl bekanntes Habitat der Archaeen. Die Methanogenen leben in diesen Habitaten eng vergesellschaftet mit Bakterien oder Protozoen.
Die Methanogenese wird von Archaeen betrieben, die alle zur Phylum der Euryarchaeota gehören (10, 12, 15).
Hier werden sie in den Klassen Methanobacteria, Methanococci, Methanomicrobia und Methanopyri geführt.
Methanogene Archaeen finden sich dabei in folgenden Ordnungen: Methanobacteriales, Methanococcales, Methanomicrobiales, Methanosarcinales, Methanpyrales sowie Methanocellales. Die Ordnung Thermoplasmatales aus der Klasse der Thermoplasmata ist eng verwandt mit den bereits genannten Archaeen und wird deshalb auch dem Phylum Euryarchaeota zugeordnet (12, 21).
Die CH4-bildenden Archaeen im Pansen sind sowohl in der Pansenflüssigkeit, angeheftet an ruminalem Partikelmaterial oder in Einheit mit Protozoen (Endosymbionten) zu finden oder am Pansenepithel des Wirtes befestigt (10).
Methanogene aus der Gattung Methanobrevibacter2 sind die am stärksten vertretenen Archaeen im Verdauungstrakt von Pflanzenfressern (Tabelle 1).
| Tabelle 1: Populationsstruktur von Methanbildnern bei Rindern (nach einer Zusammenstellung von (29)) | |||
|---|---|---|---|
| Wirt (Rasse) | Populationsstruktura) | Mbr.* in Prozent | Quelle |
| Milchrinder (Holsteins) | (unbest.)b) Mbr. (36,6 %) (unbest.) Methanosphaera (26,8 %) Mbr. ruminantium (21,9 %) (unbest.) Methanosarcinales (14,6 %) | 58,5 | Whitford et al. (2001) |
| Milchrinder (Holsteins) | (unbest.) Mbr. (87,3 %) Mbr. smithii (7,8 %) | 98,2 | Hook et al. (2009) |
| Milchrinder (Holsteins) | Mbr. millerae (73,0 %) (unbest.) Mbr. (9,9 %) Mbr. gottschalkii (9,9 %) Mbr. ruminantium (5,9 %) | 98,7 | Hook et al. (2011) |
| Milchrinder (Holsteins) | Mbr. ruminantium (28,3 %) (unbest.) Mbr. (47,8 %) Mbr. millerae (16,7 %) | 96,1 | King et al. (2011) |
| Milchrinder (Jerseys) | Mbr. ruminantium (33,3 %) (unbest.) Methanosphaera (33,3 %) (unbest.) Mbr. (26,7 %) | 60,0 | Skillman et al. (2006) |
| Milchrinder (Jerseys) | Mbr. millerae (34,6 %) Mbr. ruminantium (33,0 %) (unbest.) Mbr. (28,6 %) | 97,8 | King et al. (2011) |
Anmerkungen: * Methanobrevibacter; a) nur Populationen, deren Frequenz mehr als fünf Prozent ausmachte, hier genannt; b) unbest.: hier im Sinne von: eine weitere Spezifizierung konnte nicht exakt erfolgen.
Bereits (10) berichten, dass durchschnittlich 61,6 Prozent der detektierten ruminalen Archaeen der Gattung Methanobrevibacter angehören. Innerhalb der Gattung Methanobrevibacter sind M. gottschalkii (33,6 Prozent aller ruminalen Archaeen) oder M. ruminantium (27,3 Prozent aller ruminalen Archaeen) bestimmend.
Im Jahre 1958 isolierten (23) die Art Methanobrevibacter ruminatium; ein Archaeon, wie der Name erkennen lässt, im Pansen von Wiederkäuern.
Im Pansen fungieren die Methanogene als "End"-konsumenten der anaeroben Nahrungskette (8).
Zahlreiche Methanogene betreiben die Methanogenese mit Kohlenstoffdioxid (CO2) als Substrat, bei der Wasserstoff (H2) als primäres Reduktionsmittel verwendet wird; die sogenannten hydrogenotrophen Archaeen3 (Abbildung 1).
Es gibt jedoch zusätzlich eine bemerkenswerte Vielfalt an weiteren archaeellen Substratspezialisten (Tabellen 2 und 3).
| Tabelle 2: Einige ausgewählte Substrate für die Methan-Bildung* | |
|---|---|
| Substrat | Reaktion in der Methanogenese |
| H2 und CO2 | 4 H2 + CO2 → CH4 + 2 H2O |
| Essigsäure (Acetat-Anion: CH3COO-) | CH3COOH → CH4 + CO2 |
| Ameisensäure (Anion: Formiat, HCOO-) | 4 HCOOH → CH4 + 3 CO2 + 2 H2O |
| Methylamin** | 4 CH3NH2 + 2 H2O → 3 CH4 + CO2 + 4 NH3 |
| Methanol*** und H2 | CH3OH + H2 → CH4 + H2O |
| Methanol (bei Abwesenheit von H2) | 4 CH3OH → 3 CH4 + 2 H2O + CO2 |
Anmerkungen: * Quellen: 8, 15, 21; ** bei methanogenen Thermoplasmata kürzlich auch beschrieben (21); *** auch als Methylalkohol bekannt.
| Tabelle 3: Effekte verschiedener Substanzen für das Wachstum ausgewählter Methanogene | ||
|---|---|---|
| getestete Methanogene Spezies (Linie/Genotyp) | Substratkombination | beobachtetes Wachstum* |
| Methanobrevibacter olleyae (229/11) | H2/CO2 | +++ |
| H2/CO2 + Acetat | ++ | |
| Methanobrevibacter smithii (R4C) | H2/CO2 | + |
| H2/CO2 + Acetat | + | |
| Methanobrevibacter ruminantium (M1) | H2/CO2 | - |
| H2/CO2 + Acetat | + bis ++ | |
| H2/CO2 + Formiat | ++ bis +++ | |
| H2/CO2 + Formiat + Methanol + Acetat | ++ bis +++ | |
Quelle: (12, stark gekürzt)
Anmerkungen: * Bedeutung: +++ sehr gutes Wachstum, + wenig Wachstum, - kein Wachstum.
Während zwischenzeitlich viele methanogene Species bekannt sind, die H2 und CO2 umsetzen können, ist die Zahl der (bisher bekannten) Arten, die Essigsäure zu Methan umzuwandeln vermögen (acetoklastische Methanogene), geringer.
Die Zahl derjenigen Archaeenarten, die Methanol zu Methan umzusetzen vermögen, scheint sehr gering zu sein (12, 15).
(12) prüfte die erforderlichen Substrate für verschiedene Species (Linien) der Gattungen Methanobrevibachter, Methanobacterium und Methanospaera (Tabelle 3). So benötigt Methanobrevibacter olleyae (229/11) für sein Wachstum die Anwesenheit von H2 und CO2. Demgegenüber wächst Methanobrevibacter ruminantium (M1) nicht in einem ausschließlichen H2/CO2-Substrat. Es benötigt zusätzlich Acetat oder Formiat und wächst besonders, wenn neben H2 und CO2 gleichzeitig zusätzlich eine Kombination von Acetat, Formiat und Methanol vorhanden ist (Tabelle 3).
Obwohl die methanogenen Archaeen nur einen kleinen Teil der mikrobiellen Biomasse im Pansen ausmachen, spielen sie somit eine enorm wichtige Rolle in der gesamten Pansenphysiologie. Ihre Fähigkeit H2 direkt zu verwerten, reduziert die inhibitorische Wirkung von H2 auf die gesamte mikrobielle Fermentation im Pansen.
CH4 entsteht – wie bereits beschrieben – als unvermeidliches Nebenprodukt des mikrobiellen Kohlenhydrat-Abbaus unter anaeroben Bedingungen (Abbildung 1).
Von den verschiedenen Einflussfaktoren hat bereits die Höhe der Futteraufnahme einen deutlichen Einfluss auf die tägliche CH4-Emission bei Wiederkäuern (17). Bezogen auf ein Kilogramm Trockensubstanzaufnahme (TA) schwanken die Angaben über die Höhe der CH4-Bildung zwischen etwa 18 und 25 Gramm bei laktierenden Milchkühen (8). Extreme Werte werden häufig durch hohe Anteile spezifischer Futtermittel (Nährstoffe) verursacht, wobei eine niedrige CH4-Menge vor allem bei stärke- und fettreichen Rationen und eine hohe CH4-Bildung vor allem bei faserreichen Rationen gemessen werden.
(25) berichteten kürzlich von einer mittleren CH4-Emission von 21,5 ± 2,46 g/kg TA und 13,9 ± 2,30 g/kg Milch (FCM) bei hochleistenden Milchkühen.
Zweifellos hat die verabreichte Diät einen bedeutenden Einfluss auf die beobachtete Methanemission vergleichbarer Tiergruppen (Mastbullen, laktierende Milchkühe und andere). Es gibt zwischenzeitlich aber auch klare Belege dafür, dass zwischen den Tieren (Wirten) tierindividuelle Unterschiede – bei Verabreichung einer gleichen Diät – existieren, die wiederholbar und damit züchterisch nutzbar sind.
Hier liegen gesicherte Ergebnisse vor allem mit Schafen – getestet unter experimentellen Bedingungen (unter anderem Respirationskammern) – vor, da ihre Prüfung vergleichsweise weniger aufwendig und kostenintensiv als eine Bewertung von Rindern (Milchkühen) ist.
(20) berichten über eine Heritabilität (Erblichkeit, h2) von etwas über zehn Prozent für die Methanemission je Kilogramm aufgenommener Futtertrockenmasse (T) bei Schafen (Tabelle 4).
| Tabelle 4: Berechnete Heritabilitäten (h2) und Wiederholbarkeiten (r2) für die Methanemission von Schafen | ||||
|---|---|---|---|---|
| Merkmal/Kenngröße | Mittelwerte | Phänotypische Standardabweichung (sp) | h2 | r2 |
| g CH4/Tag | 24,6 | 3,18 | 0,29 ± 0,05 | 0,53 ± 0,02 |
| g CH4/kg T | 15,7 | 1,62 | 0,13 ± 0,03 | 0,24 ± 0,02 |
| Lebendmasse | 48,5 | 5,12 | 0,46 ± 0,07 | 0,80 ± 0,01 |
Quelle: (20, gekürzt).
Anmerkungen: T = Trockenmasse; Tiermaterial: 1225 Schafe.
Zu vermerken ist, dass gleichzeitig auch die Retentionszeit des Futters im Verdauungstrakt eine erhebliche Variation zwischen verschiedenen Tieren innerhalb einer Rasse besitzt.
(24) belegen bei 58 Merino-Böcken (zweijährig) eine zugehörige mittlere Wiederholbarkeit von r2 = 0,45.
(5) berichten über deutliche pansenmorphologische Unterschiede zwischen Schafen mit differenzierten Methanemissionen (Tabelle 5). Sie wählten aus einer Probandengruppe von über 700 Schafen je zehn Tiere mit hoher oder niedriger Methanemission aus. Mittels CT (Computertomografie) wurde anschließend die zugehörige ruminale Morphologie der Mutterschafe analysiert.
| Tabelle 5: Beobachtete Unterschiede zwischen zwei Mutterschafgruppen (je zehn hohe oder zehn niedrige Methanemittenten bewertet) | |||
|---|---|---|---|
| Kenngröße | hohe Methanemittenten | niedrige Methanemittenten | Signifikanz (P-Werte) |
| Körpermasse (kg) | 61,4 | 58,4 | n. s. |
| T-Aufnahme je Tag | 1026 | 988 | n. s. |
| Methanerzeugung (g CH4/kg T-Aufnahme) | 23,5 | 20,8 | 0,001 |
| Verdaulichkeit der T (in Prozent) | 66,4 | 64,8 | n. s. |
| mittlere Retentionszeit in Tagen – d (partikelbasierend) | 1,34 | 1,11 | 0,002 |
| Pansenvolumen (Liter) | 7,42 | 5,91 | 0,048 |
Quelle: (5, gekürzt).
Anmerkungen: n. s. = nicht signifikant; T = Trockenmasse.
Die niedrigen Methanemittenten hatten ein kleineres Pansenvolumen und eine kürzere Retentionszeit bezüglich des aufgenommenen Futters. Die Verdaulichkeit war jedoch zwischen den beiden Schafgruppen nicht signifikant verschieden (Tabelle 5). Diese Ergebnisse sind insofern für die Zuchtpraxis sehr interessant, da eine einseitige Selektion auf reduzierte Methanemission somit gleichzeitig auch weitere tierseitige Änderungen bewirken dürfte (Tab. 5).
(27) berichten über die Methanerzeugung von Mastbullen unterschiedlicher Rinderrassen (Tabelle 6).
| Tabelle 6: Methanerzeugung von Mastbullen in Abhängigkeit von der Rasse und der Futterration | ||||||
|---|---|---|---|---|---|---|
| Rationstyp | kraftfutterreiche Diät | Diät mit mittlerem Kraftfutteranteil | Signifikanzprüfung | |||
| Rasse | AA* | Lim* | AA | Lim | Rasse | Futter |
| Gramm Methan pro Tag | 152 | 135 | 216 | 194 | * | *** |
| Gramm Methan je Kilogramm T-Aufnahme | 13,5 | 13,6 | 21,3 | 22,3 | n. s. | *** |
Quelle: (27).
Anmerkungen: * Abk.: AA = Aberdeen-Angus; Lim = Limousin-Kreuzungen; T = Trockenmasse; *** P < 0,001; * P < 0,05; n. s. = nicht signifikant.
Die Mastrinder aus zwei verschiedenen Rassengruppen (n = 35 Aberdeen Angus-Bullen sowie n = 33 Limousin-Kreuzungen) emittierten eine unterschiedliche Methanmenge je Tag. Wurde jedoch die Methanemission bezüglich der verzehrten Trockenmasse (T) korrigiert, waren die Unterschiede zwischen den Rassen nicht mehr gegeben (Tabelle 6).
(2) untersuchten die Struktur der ruminalen Methanogene bei wachsenden Rindern mit hoher versus niedriger RFA (je 14 weibliche Tiere aus beiden RFA-Gruppen). Sie belegen eine hohe strukturelle Ähnlichkeit der methanogenen Community in beiden Gruppen.
Methanobrevibacter spp. waren die dominierenden Methanogene im Pansen; gleichzeitig war die genetische Variabilität innerhalb von Methanobrevibacter smithii die vielfältigste (2). Lediglich zwei Genotypen von Methanobrevibacter smithii waren signifikant häufiger in der Färsen-Gruppe mit hoher RFA im Vergleich zur niedrigen RFA-Gruppe.
Zusätzlich wurden Häufigkeitsunterschiede von Methanobrevibacter smithii und Methanosphaera stadtmanae in Abhängigkeit von der verabreichten Diät (Raufutteranteil: hoch oder gering) aufgezeigt.
Zwischenfazit: Die aktuell vorliegenden Ergebnisse zeigen, dass einerseits ein "ruminaler Kern" von Methanogenen im Pansen existiert und anderseits die Fütterung sowie zum Teil (noch unbekannte) Komponenten des Wirts signifikante Unterschiede in der Häufigkeitsverteilung vorhandener methanogener Genotypen bewirken können.
Eine futterabhängige Diversität vorhandener Bakterien und Methanogene im Pansen – in Kombination mit weiteren vom Wirt abhängigen Effekten – sollten vorhandene Unterschiede in der Methanerzeugung von differenzierten RFA-Rindern erklären können.
Wirt-bezogene Faktoren, wie die Pansen-Morphologie, das Fressverhalten, die Thermoregulation und auch Stress, haben offensichtlich einen Einfluss auf die beobachtbare Futterverwertung und die Methanbildung.
Die Gesamtheit der Gene eines Organismus, egal ob Wirt oder Symbiont, stellt eine riesige Menge an Informationen dar.
Vergleichsweise wenige Gene werden ständig zur Aufrechterhaltung der Grundfunktionen einer lebenden Zelle benötigt. Ihre Aktivität wird reguliert, das heißt sie werden je nach Bedarf "an- oder abgeschaltet".
Als Transkriptom bezeichnet man die Gesamtheit der RNA-Moleküle einer Zelle (während eines bestimmten Entwicklungszustandes) als Produkte derjenigen Gensequenzen, die gerade "angeschaltet" sind ("RNA-Profil").
Generell kann eine Regulation der Genexpression auf verschiedenen Stufen stattfinden (Abbildung 2).
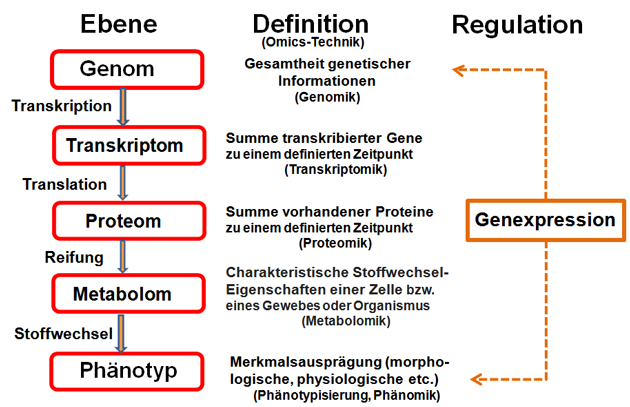
Abbildung 2: Einbeziehung verschiedener Omics-Techniken in eine Genexpressionsanalyse
(22) haben sich erstmalig genau dieser Fragestellung im Zusammenhang mit der Methanproduktion bei Schafen gestellt. Sie nutzten zwei Schafgruppen: je vier Schafe mit hoher oder niedriger Methanproduktion bei gleicher Diät (ad libitum). Die Differenz zwischen den beiden Gruppen war mit 4,41 Gramm CH4 pro Kilogramm Trockensubstanzaufnahme (P = 0,0002) signifikant verschieden.
Die Struktur der ruminalen mikrobiellen Gemeinschaft zwischen den beiden Schafgruppen erklärte nur einen Teil der Emissionsunterschiede. Keine der beteiligten Domänen (Bacteria, Archaea, Eukaryota) zeigten eine signifikante Veränderung der relativen Häufigkeit zwischen den niedrigen oder hohen CH4-Emittenten (Abbildung 3).
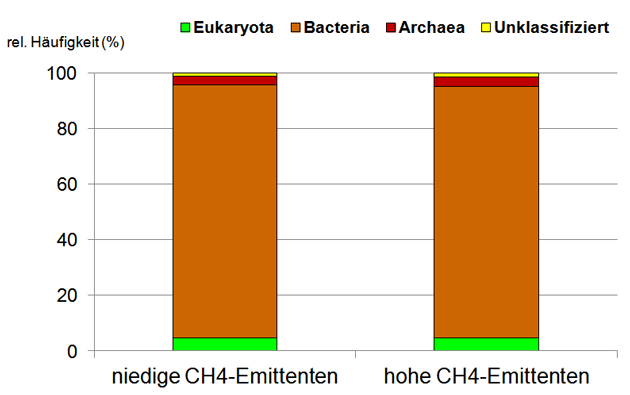
Abbildung 3: Struktur verschiedener Domänen im Pansemmikrobiom verschiedener CH4-Emittenten.
Quelle: (22) – eigene Darstellung.
Detaillierte Analysen der Zusammensetzung der Methanobacteria-Community auf Gattungs- oder Artebene zeigten erhöhte Methanosphaera spp. bei den niedrigen CH4-Emittenten. Während bei den Schafen mit hoher Methanemission Methanobrevibacter gottschalkii erhöht war (Abbildung 4). Diese relativen Häufigkeitsunterschiede waren zwar zum Teil signifikant; insgesamt aber wenig bedeutend. Demgegenüber war die Genexpression deutlich mit der Methanproduktion gekoppelt .
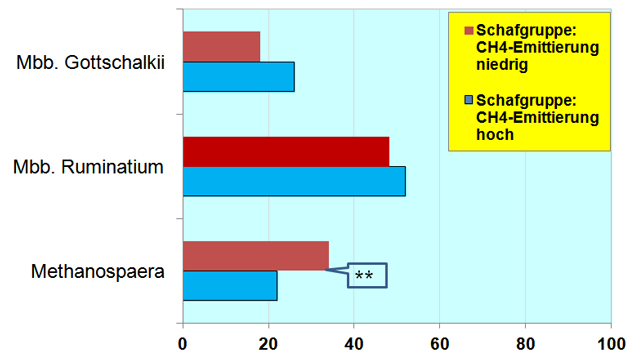
Abbildung 4: Struktur der Methanobacteria auf Gattungs-/Artebene in zwei Schafgruppen.
Quelle: in Anlehnung an (22) – eigene Grafik.
Anmerkungen: ** Signifikanz (P < 0,05).
Für sieben von zehn enzymgesteuerte Schritte in der Methanogenese beobachteten (22) signifikante Zunahmen bezüglich der Häufigkeit der Transkripte4 je enzymverschlüsselndes Gen bei den hoch CH4-emittierenden Schafen. Die Expression von Genen, die an der Methanproduktion beteiligt sind, differierte deutlich zwischen den beiden Schafgruppen. Dies deutet darauf hin, dass auch der Genregulation, vielleicht durch die H2-Konzentration im Pansen oder durch eine tierindividuelle Variation der Verweilzeit des Futters im Pansen (mit-)gesteuert, eine Bedeutung zukommt.
Zwischenfazit: Eine unterschiedliche Genexpression ist an der beobachtbaren Variation der Methanproduktion beteiligt. Diese Genregulation dient möglicherweise der Anpassung an eine wechselnde Umgebung; zum Beispiel an ein wechselndes Nährstoffangebot (H2-Angebot).
Beim aktuellen Kenntnisstand werden vorrangig indirekte Methan-Minderungsstrategien empfohlen (Abbildung 5).
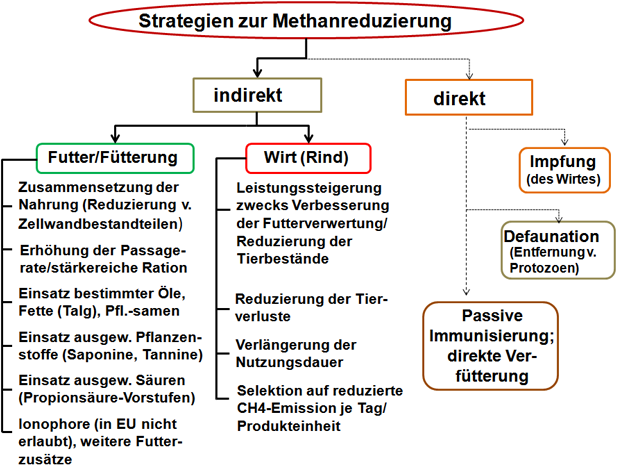
Abbildung 5: Mögliche Strategien zur Methanreduzierung.
Quelle: Eigene Darstellung.
Bereits die Höhe der Futteraufnahme hat einen Einfluss auf die tägliche CH4-Emission bei Wiederkäuern.
Indirekte CH4-Reduzierungsstrategien bietet die Zusammensetzung der Nahrung (Abnahme des Anteils schwer verdaulicher Zellwandbestandteile, Zunahme des Kraftfutteranteils in der Diät, Erhöhung der Passagegeschwindigkeit, Beeinflussung des pH-Wertes (methanbildenden Mikroorganismen werden bei einem Pansen-pH-Wert von < 5,8 stark gehemmt), Lipid-Ergänzung und anderes) (8, 6, 14).
Neben den Bemühungen, die CH4-Bildung im Pansen durch Futterinhaltsstoffe oder die Rationsgestaltung zu reduzieren, wurde auch immer wieder versucht, spezifische Futterzusatzstoffe diesbezüglich zu nutzen.
Beispiel: Monensin, ein Wirkstoff aus der Gruppe der Ionophoren (ein Antibiotikum gebildet von Streptomyces cinnamonensis). In Nordamerika wird es gezielt vermarktet, um eine generell bessere Futterverwertung und Gewichtszunahme beispielsweise bei Mastrindern zu erreichen (in der Europäischen Union nicht generell zugelassen5).
Nach (4) resultiert die verringerte CH4-Bildung nach diesem Ionophoren-Einsatz aus einer verminderten Protozoen-Population im Pansen, die sich im Zeitverlauf aber wieder adaptieren kann.
Eine Rotation zwischen mehreren Ionophoren (zum Beispiel Monensin und Lasalocid) verhinderte die Adaptation der Protozoen in diesen Versuchen (4).
Da seit Januar 2006 EU-weit der Einsatz von Antibiotika als generelle Futterzusatzstoffe nicht mehr gestattet ist, entfällt diese Möglichkeit zur Reduzierung der CH4-Bildung aktuell in der Europäischen Union.
Eine unmittelbare genetisch-züchterische Einflussnahme auf die tierindividuelle CH4-Emission ist zurzeit (noch) nicht realisierbar, da keine Informationen über ausreichend viele Einzeltiere in praxi vorliegen.
Der Züchter kann somit nur durch indirekte Maßnahmen Einfluss auf die CH4-Emissionen je erzeugter Produkteinheit (Milch, Fleisch) nehmen.
Hier bieten sich unter anderem an:
Durch eine höhere Produktivität der Milchkühe lässt sich der notwendige Tierbestand – konstanter Milch-/Fleischbedarf bundesweit vorausgesetzt – reduzieren. Höhere Leistungen sind in der Regel aber auch mit einem zunehmenden Kraftfuttereinsatz verbunden.
Eine weitere Strategie zur generellen Minderung der Methanbildung wird von einigen Tierwissenschaftlern in der Entwicklung eines Impfstoffs für Wiederkäuer gesehen, um ihr Immunsystem zur Stimulierung der Antikörperbildung gegen CH4-produzierende Archaeen anzuregen (28).
Das Pansenepithel des Wirtes ist jedoch nicht sekretorisch. Daher verbleibt als möglicher Weg für die Antikörper die Speichelsekretion. Zusätzlich hängt die Wirksamkeit des Ansatzes vom "Überleben" der Antikörper im Pansen und deren Bindung an die Zielmikroben ab. Ein schwieriger Weg.
Ein weiterer Ansatz, um Antikörper in den Pansen zu verbringen, wäre als spezifischer Futterzusatz (passive Immunität).
So wurde Bakteriozin6 oder eine Bakteriozin-ähnliche Substanz in bestimmten Stämmen von Butyrivibrio, Ruminococcus, Streptococcus und Lactobacillus beobachtet (9, 11).
Einige der Bakteriozine scheinen hemmend auf Methanogene zu wirken.
Offen bleiben auch hier die Fragen nach einer Adaptation des Pansenmikrobioms nach längerer Zeit einschließlich der Möglichkeit einer speziesspezifischen Resistenzbildung und seiner Auswirkungen auf den Wirt oder die Umwelt.
Unter Defaunation versteht man das systematische Entfernen der Protozoen im Pansen.
Pansen-Protozoen leben in einer symbiotischen Beziehung mit Methanogenen (9, 14). Eine Defaunation in vivo lässt langfristig ähnliche Probleme erwarten, wie oben bereits erwähnt.
Ihre dauerhafte erfolgreiche Anwendung ist somit für die Praxis noch nicht gelöst.
In einer neueren Studie von (16) wurde der Archaeol-Gehalt im Rinderkot von laktierenden Kühen (n = 16, je acht Holstein-Kühe und acht F1-Kühe (Jersey mal Holstein)) analysiert.
Archaeol7 (Di-O-phytanylglycerol) ist ein Membranlipid von Archaeen, das auch im Rinderkot quantifiziert werden kann. Es könnte ein möglicher fäkaler Marker werden, um die generelle Aktivität von Archaeen im Pansen zu erfassen.
Die oben genannten Autoren berichteten überraschenderweise zusätzlich auch von einer positiven Beziehung zwischen der Archaeol-Konzentration im Rinderkot und der CH4-Emission (g/kg T-Aufnahme) bei Milchkühen.
Diese Ergebnisse sind insofern sehr überraschend, da bisher in keiner Studie deutliche Zusammenhänge zwischen der Gesamthäufigkeit von Archaeen im Pansen und der Methanproduktion nachgewiesen wurden. Auch die genetische Diversität bezüglich des Vorhandenseins spezifischer Archaeen-Species und der CH4-Bildung scheint eher subtil zu sein (22).
Weitere Arbeiten dürften erforderlich sein, um die Zusammenhänge zwischen der Archaeol-Konzentration im Rinderkot und der interessierenden CH4-Emission von Individuen zu verifizieren.
In ähnlicher Weise sollten jüngste Berichte über das Fettsäureprofil der Milch von Kühen und der zugehörigen Methanemission eingestuft werden (25).
Wir wissen, dass das Fettprofil (Anteil verschiedener Fettsäuren) in der Milch stark fütterungsabhängig ist (zum Beispiel (3)) und rau- oder kraftfutterreiche Diäten zu deutlich unterschiedlichen CH4-Emissionen je Kilogramm Trockensubstanzaufnahme führen (1, 8).
Das Milchfettprofil reflektiert die praktizierte Fütterung (frisches Gras, Silage) oder den gewählten Rationstyp (viel/wenig Kraftfutter). Nicht beantwortet ist damit aktuell die Frage, ob der genetische (tierseitige) Zusammenhang zwischen der Methanproduktion des Wirtes (Milchkuh) und seinem Milchfettprofil ausreichend ist, zuverlässige Auslesestrategien von Zuchttieren aus der Blickrichtung der Züchtung daraus abzuleiten.
Methanogene gehen eine enge symbiotische Beziehung – zwecks H2-Transfer mit anderen Mikroorganismen im Pansen, einschließlich Protozoen – ein (30).
Die Herstellung von H2 von einer Spezies und seiner Verwertung von anderen, die auch als Inter-Spezies-H2-Transfer bezeichnet wird, ist eine wichtige mikrobielle Interaktion im Pansen.
Die direkte Verwertung von H2 in einem Ökosystem, das anaerob ist, ist von existentieller Wichtigkeit, da es empfindlich auf eine Erhöhung des Partialdrucks von H2 reagiert.
Obwohl die Methanogene nur etwa ein bis vier Prozent an der gesamtmikrobiellen Population im Pansen ausmachen, stellt ihre Methanogenese somit einen zentralen Pfad dar, um den anfallenden Wasserstoff "vor Ort" zu verstoffwechseln. Ein künftig möglicher Schlüssel zur weiteren Reduktion der Methanproduktion liegt somit darin, alternative Wege zu finden, um den Wasserstoff gleich für solche Produkte zu verwerten, die vorteilhafterweise durch den Wirt (Host) weitergenutzt werden können (Abbildung 6).
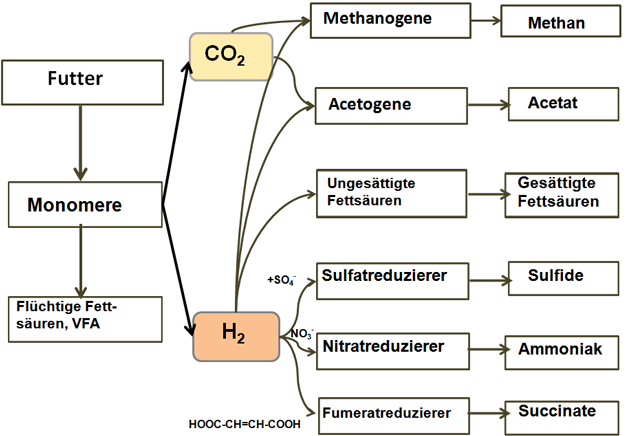
Abbildung 6: Theoretisch mögliche Einbeziehung des Wasserstoffes an differenzierte Reaktionen im Pansen.
Quelle: (11, 30) – eigene Grafik.
So ist die reduktive Acetogenese ein theoretisch möglicher Weg der H2-Verwendung, die wiederum von acetogenen Bakterien8 durchgeführt werden könnte. Diese Bakterien verwenden CO2 und H2 zur Acetat-Bildung.
Versuche mit acetogenen Bakterien im Pansen waren aber nur von sehr begrenztem Erfolg, weil eine geringere H2-Affinität der acetogenen Bakterien gegenüber den archaeellen Methanogenen existiert. Unbekannt ist auch, weshalb die Acetogene und Methanogene nicht im Verdauungstrakt längerfristig koexistieren (7, 9, 11, 30).
Ebenso könnten Nitrat- oder Sulfat-Salze gezielt zur Reduzierung der CH4-Bildung verwendet werden (26). So sind sulfatreduzierende Bakterien9 (Desulfurikanten) durch ihre Fähigkeit gekennzeichnet, den Substratwasserstoff auf Sulfat zu übertragen und dabei Sulfat zu Sulfid zu reduzieren (Sulfat-Atmung).
In der Tat hat eine (zeitlich sehr begrenzte) zusätzliche Verabreichung von Nitrat- oder/und Sulfat-Salzen mit dem Futter an Schafe eine Reduktion der CH4-Bildung gezeigt (26).
Bekannt ist aber auch, dass eine dauerhaft hohe Dosis beispielsweise von Nitraten im Wiederkäuerfutter zu einer Methämoglobinämie10 führt.
(19) schlagen sogar vor, eine Kombination aus Nitraten, Saponinen und Sulfaten als Strategie zur Methanreduktion bei Wiederkäuern zu nutzen. Die Toxizität der Kombination wurde aber nicht diskutiert.
Offen ist die Frage, wie Sulfat- und/oder Nitrat-Salze auf sichere Art und Weise dem Wiederkäuer (als Futtermittelzusatzstoff) – bei Vermeidung einer Toxizität sowie einem gleichzeitigen Leistungsabfall – längerfristig zugeführt können (Van Zijderveld et al., 2010).
Wir stehen auch hier erst am Anfang, wissenschaftliche "Vorlauf"-studien zu etablieren.
Auch helfen hier Ergebnisse aus In-vitro-Studien nicht weiter, da damit toxische Effekte und/oder eine Leistungsminderung beim Wirt nicht quantifiziert werden können.
Möglicherweise ist die Beeinflussung der Genexpression zukünftig – neben der gezielten strukturell-funktionellen Beeinflussung des Pansenmikrobioms – ein völlig neuer Weg, die ruminale Methanproduktion der Wiederkäuer gezielt zu verändern.
Schließlich spielt auch der Standort des Wirts mit seinen zugehörigen differenzierten Umwelt- und Fütterungsbedingungen eine Rolle, welche mikrobielle Vielfalt im Host zu finden ist. Es sollte deshalb auch nicht ausgeschlossen werden, dass standortspezifische Aspekte zukünftig zusätzlich zu beachten bleiben und davon abhängig verschiedene Wege bezüglich einer angestrebten Minderung der CH4-Emissionen bei Wiederkäuern verfolgt werden müssen. Beim gegenwärtigen Wissensstand empfehlen sich aktuell nur indirekte Maßnahmen in praxi (Abbildung 5).
Da allerdings weltweit an Minderungsstrategien zur CH4-Emission bei Wiederkäuern gearbeitet wird, sind die Erwartungen hoch, zukünftig direkt in die Aktivitäten der methanogenen Archaeen beim Wiederkäuer eingreifen zu können.
Die Zukunft wird es zeigen!
Archaeen sind ein wichtiger Bestandteil des Pansenmikrobioms. Obwohl die methanogenen Archaeen nur einen kleinen Teil der mikrobiellen Biomasse im Pansen ausmachen, spielen sie eine enorm wichtige Rolle in der gesamten Pansenphysiologie. Ihre Fähigkeit Wasserstoff (H2) zu verwerten, reduziert die inhibitorische Wirkung von H2 auf die gesamte mikrobielle Fermentation im Pansen.
Der vorliegende Übersichtsartikel fasst die aktuellen Erkenntnisse über die im Pansen vorhandenen Archaeen zusammen und beschreibt mögliche Ansätze zur weiteren Minderung der Methanemission von Rindern.
Wir sind noch weit davon entfernt, eine gezielte Manipulation des ruminalen Mikrobioms im großen Umfang in praxi am Wiederkäuer vornehmen zu können. Es bleibt jedoch ein strategisches Ziel.
The ruminal microbiome of cattle
Part 2: Archaea – substrate specialists in the ruminal microbiome
Archaea are an important part of the ruminal microbiome. Although the methanogenic archaea make up only a small part of the microbial biomass in the rumen, they play an extremely important role in the whole rumen physiology. Their ability to utilize hydrogen (H2), reduces the inhibitory effect of H2 on the total microbial fermentation in the rumen.
This review article summarizes the current knowledge of archaea in the rumen and describes possible approaches to further reduce the methane emissions of cattle.
We are still far from being able to manipulate the ruminal microbiome selectively and on a large scale in practice. However, it remains a strategic objective.
Le microbiome ruminal des bovins
2e partie : les archéens – spécialistes du substrat dans le rumen du microbiome
Les archéens représentent une partie importante du microbiome ruminal.
Bien que les archéens méthanogènes ne constituent qu’une faible partie de la biomasse microbienne dans le rumen, ils jouent un rôle considérable dans toute la physiologie ruminale. Leur capacité d’exploiter l’hydrogène (H2) réduit l’effet inhibiteur de H2 sur l’ensemble de la fermentation microbienne dans le rumen.
Le présent article de synthèse regroupe les connaissances actuelles sur les archéens existant dans le rumen et décrit des approches possibles en vue de réduire l’émission de méthane par les bovins.
Nous sommes encore loin de pouvoir entreprendre une manipulation ciblée du microbiome ruminal sur une grande échelle et dans la pratique appliquée aux ruminants. Ceci reste pourtant un objectif stratégique.
1) Zu nennen sind hier Unterschiede in der Sequenz der in den Ribosomen enthaltenen RNA; erfassbar in Form der kleinen ribosomalen Untereinheit 16S rRNA (13).
2) Zugehörige zoologische Klassifikation: Phylum: Euryarchaeota, Klasse: Methanobacteria, Ordnung: Methanobacteriales, Familie: Methanobacteriaceae, Genus: Methanobrevibacter, Species: M. ruminantium; zur gleichen Gattung gehören auch die wiederholt im Pansen von Wiederkäuern gefundenen Spezies: M. gottschalkii, M. millerae, M. smithii. Weitere zehn Species gehören zur Gattung Methanobrevibacter (12, 15).
3) Die Reduktion von Kohlenstoffdioxid zu Methan durch Wasserstoff ist exergon (energiefreisetzend).
4) Die Transkription beschreibt die Synthese von RNA nach der DNA-Vorlage. Unter Genexpression versteht man die Bildung von Proteinen (Enzymen) anhand der genetischen Information mitsamt aller dafür nötigen vorangehenden Prozesse; beginnend mit der Transkription. Die Genexpression kann durch eine Genexpressionsanalyse bestimmt werden.
5) Monensin ist seit April 2013 ausschließlich zur Behandlung von Stoffwechselentgleisungen bei Milchkühen und Färsen in der Europäischen Union zugelassen. Das unter der Bezeichnung Kexxtone® Monensin Natrium angebotene Pharmazeutikum muss vom Tierarzt verschrieben und als Bolus mit Hilfe eines Applikators verabreicht werden. Das Rind muss laut Herstellerangaben für eine Stunde separiert und im Anschluss an die Behandlung für bis zu vier Tage unter Beobachtung stehen, damit der Landwirt erkennen kann, ob der Bolus auch wirklich geschluckt ist (18).
6) Bacteriozine sind proteinogene Toxine, die von Bakterienstämmen abgesondert werden und das Wachstum anderer Stämme derselben oder ähnlicher Bakterienarten hemmen (inhibieren). Bacteriozine haben meist ein enges Wirtsspektrum (9, 21).
7) Archaeol ist ein Glycerin-Derivat (16).
8) Acetogene Bakterien bilden unter anaeroben Bedingungen Essigsäure (Acetat). Zu den acetogenen Bakterien gehören zum Beispiel Arten der Gattung Acetobacterium und Clostridium. Sie kommen häufig im Schlamm von Gewässern sowie in Faultürmen von Kläranlagen vor (7, 15).
9) Sulfatreduzierer sind obligat anaerob und leben vor allem in Gewässersedimenten (9, 15, 26). Sie sind leicht aus Faulschlamm zu isolieren, wo sie die beim unvollständigen Abbau von Kohlenhydraten anfallenden Fettsäuren und Alkohole nutzen und somit zur anaeroben Mineralisierung organischer Substanzen beitragen. Mehrere Gruppen, darunter gram-negative begeißelte und nicht begeißelte Bakterien (zum Beispiel Desulfovibrio, Desulfobacterium, Desulfococcus, Desulfomonas), gram-positive, endosporenbildende Bakterien (Desulfotomaculum) und Archaeen (Archaeglobulus), sind zur Sulfatatmung befähigt (15).
10) Bei einer Methämoglobinämie ist eine erhöhte Konzentration von Methämoglobin im Blut zu finden. Aus der Humanmedizin ist gut bekannt, dass vor allem für Säuglinge zum Beispiel durch den Genuss von Trinkwasser mit zu hohen Nitratwerten die Gefahr einer Anämie – aufgrund einer geringeren Enzymaktivität – besteht.
Prof. Dr. habil. Wilfried Brade
TiHo Hannover
zurzeit: Leibniz-Institut (FBN) für Nutztierbiologie Dummerstorf
Wilhelm-Stahl-Allee 2
18196 Dummerstorf
Email: brade@fbn-dummerstorf.de
Prof. Dr. habil. Ottmar Distl
Stiftung Tierärztliche Hochschule Hannover
Institut für Tierzucht und Vererbungsforschung
Bünteweg 17p
30559 Hannover
Email: ottmar.distl@tiho-hannover.de